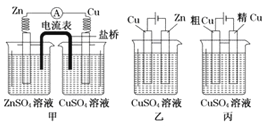
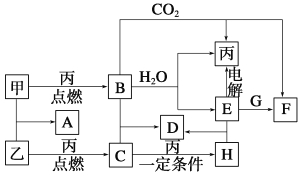
题目内容
【题目】在浓度均为6 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的铁粉,充分反应后生成气体体积比为2∶3,则加入铁粉的质量是 ( )
A.11.2 g B.25.2 g C.16.8 g D.33.6 g
【答案】B
【解析】
试题分析:发生反应为:Fe+2HCl![]() FeCl2+H2↑①、Fe+H2SO4
FeCl2+H2↑①、Fe+H2SO4![]() FeSO4+H2↑②,加入铁粉质量相等,如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,而实际气体体积之比为2:3,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量。通过方程式可以看出来,铁消耗HCl多,对于①反应来说是盐酸不足,对于②反应是Fe不足,铁与盐酸反应生成气体的物质的量为
FeSO4+H2↑②,加入铁粉质量相等,如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,而实际气体体积之比为2:3,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量。通过方程式可以看出来,铁消耗HCl多,对于①反应来说是盐酸不足,对于②反应是Fe不足,铁与盐酸反应生成气体的物质的量为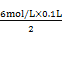 =0.3mol,反应完毕后生成气体的体积之比为2:3,所以由硫酸生成的气体的物质的量为0.45mol,设铁的质量为x,则:
=0.3mol,反应完毕后生成气体的体积之比为2:3,所以由硫酸生成的气体的物质的量为0.45mol,设铁的质量为x,则:
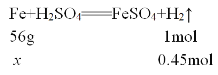
解得x=25.2g,故该题选B。

 教材全解字词句篇系列答案
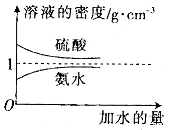
教材全解字词句篇系列答案【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中的信息,回答下列问题 :
溶质的物质的量浓度/ | 溶液的密度/ |
| |
硫酸 |
|
| |
氨水 |
|
|
(1)表中硫酸的质量分数为__________(不写单位,用含![]() 、
、![]() 的代数式表示)。
的代数式表示)。
(2)物质的量浓度为![]()
![]() 的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为___________
的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为___________![]() 。
。
(3)物质的量浓度为![]()
![]() 的氨水与
的氨水与![]()
![]()
![]() 的氨水等质量混合,所得溶液的密度______(填
的氨水等质量混合,所得溶液的密度______(填
“大于”、“小于”或“等于”,下同) ![]()
![]() ,所得溶液的物质的量浓度________
,所得溶液的物质的量浓度________![]()
![]()
![]()
(设混合后溶液的体积变化忽略不计)
(4)若将稀硫酸与氨水混合,写出其反应的离子方程式___________________________.