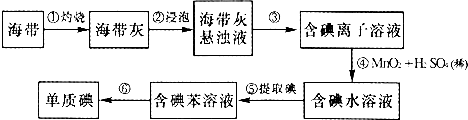
题目内容
6.磷酸铁(FePO4)为难溶于水的米白色固体,可用于制备药物、食品添加剂和锂离子电池的正极材料.实验室利用钛铁矿(主要成分为FeTiO3,含有少量MgO、CaO、SiO2等杂质)制备磷酸铁和锂离子电池正极材料(LiFePO4)的部分工业流程如图所示: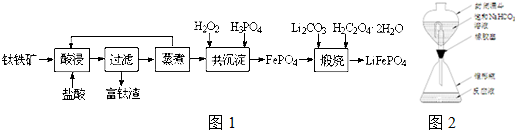
(1)富钛渣中的主要成分为TiO2和SiO2(填化学式).煅烧得到LiFePO4的化学方程式为2FePO4+Li2CO3+H2C2O4•2H2O$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO2↑+3H2O.
(2)在共沉淀步骤中加入H2O2的目的是让滤液中的Fe2+完全被H2O2氧化.
①反应的离子方程式为2Fe 2++H2O2+2H+=2Fe3++2H2O.
②下列实验条件控制正确的是AB(填序号).
A.加入适当过量的H2O2溶液 B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行 D.用氨水调节pH=7
(3)已知Ca2+、Mg2+和Fe3+离子形成磷酸盐的Ksp分别为2.0×10-29、1.0×10-24和9.9×10-16,若溶液中三种金属阳离子的浓度均为0.1mol•L-1,则加入H3PO4时首先生成沉淀的化学式为FePO4.
(4)制备LiFePO4的过程中,理论上所需 17%双氧水与H2C2O4•2H2O的质量比为100:63.
(5)钛铁矿中钛含量的测定步骤为:
①还原.将含钛试样溶解于强酸溶液中,再加入铝片将TiO2+还原为Ti3+,并将Fe3+还原.反应装置如图所示,使用封闭漏斗的目的是避免生成的Ti3+被空气氧化.
②滴定.取下封闭漏斗,向锥形瓶中加入2~3滴KSCN溶液,立即用FeCl3 标准溶液滴定至终点,记录读数.
③计算.下列操作会导致测定结果偏低的是bc.
a.还原操作结束后铝片有剩余
b.还原操作结束后,反应液仍呈黄色
c.缓慢滴定,且剧烈振荡锥形瓶,但无溶液溅出.
分析 钛铁矿(主要成分为FeTiO3,含有少量MgO、CaO、SiO2等杂质)用盐酸溶解后可以得到含有Ca2+、Mg2+、Fe2+、Fe3+的溶液和含有TiO2、SiO2的固体,过滤后在滤液中加入双氧水和磷酸,可得到FePO4固体,将FePO4、Li2CO3、H2C2O4•2H2O煅烧可得到LiFePO4,
(1)根据流程分析,SiO2是不溶于酸的,根据元素守恒可写出煅烧得到LiFePO4的化学方程式;
(2)①Fe2+与H2O2在酸性条件下发生氧化还原反应生成Fe3+和水;
②由于双氧水易受热分解,所以双氧水要适当过量,且加入的速度要慢,以防止反应过快,温度升高,Fe2+与H2O2在酸性条件下发生氧化还原反应;
(3)物质的Ksp越小,越容易形成沉淀;
(4)根据电子得失守恒可知H2O2~2Fe3+,根据煅烧中的反应方程式可知2FePO4~H2C2O4•2H2O,所以H2O2~H2C2O4•2H2O,据此进行计算;
(5)①Ti3+易被空气氧化;
③a.还原操作结束后铝片有剩余,会多消耗FeCl3 标准溶液,
b.还原操作结束后,反应液仍呈黄色,说明FeCl3 标准溶液不足;
c.缓慢滴定,且剧烈振荡锥形瓶,但无溶液溅出,溶液中部分Ti3+会被空气中的氧气氧化,会导致FeCl3 标准溶液消耗量偏少.
解答 解:钛铁矿(主要成分为FeTiO3,含有少量MgO、CaO、SiO2等杂质)用盐酸溶解后可以得到含有Ca2+、Mg2+、Fe2+、Fe3+的溶液和含有TiO2、SiO2的固体,过滤后在滤液中加入双氧水和磷酸,可得到FePO4固体,将FePO4、Li2CO3、H2C2O4•2H2O煅烧可得到LiFePO4,
(1)根据流程分析,SiO2是不溶于酸的,所以富钛渣中的主要成分是TiO2和SiO2,根据元素守恒可知煅烧得到LiFePO4的化学方程式为2FePO4+Li2CO3+H2C2O4•2H2O$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO2↑+3H2O,
故答案为:SiO2;2FePO4+Li2CO3+H2C2O4•2H2O$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO2↑+3H2O;
(2)①Fe2+与H2O2在酸性条件下发生氧化还原反应生成Fe3+和水,反应的离子方程式为2Fe 2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe 2++H2O2+2H+=2Fe3++2H2O;
②由于双氧水易受热分解,所以双氧水要适当过量,且加入的速度要慢,以防止反应过快,温度升高,Fe2+与H2O2在酸性条件下发生氧化还原反应,
故选AB;
(3)物质的Ksp越小,越容易形成沉淀,FePO4的Ksp为2.0×10-29是最小,所以Ca2+、Mg2+和Fe3+三种金属阳离子的浓度均为0.1mol•L-1时,加入H3PO4首先生成沉淀的化学式为FePO4,
故答案为:FePO4;
(4)根据电子得失守恒可知H2O2~2Fe3+,根据煅烧中的反应方程式可知2FePO4~H2C2O4•2H2O,所以H2O2~H2C2O4•2H2O,即H2O2和H2C2O4•2H2O的物质的量之比为1:1,所以17%双氧水与H2C2O4•2H2O的质量比为$\frac{34}{17%}:(100+36)$=200:136=100:63,
故答案为:100:63;
(5)①Ti3+易被空气氧化,所以使用封闭漏斗的目的是避免生成的Ti3+被空气氧化,
故答案为:避免生成的Ti3+被空气氧化;
③a.还原操作结束后铝片有剩余,会多消耗FeCl3 标准溶液,会导致测定结果偏高;
b.还原操作结束后,反应液仍呈黄色,说明FeCl3 标准溶液不足,会导致测定结果偏低;
c.缓慢滴定,且剧烈振荡锥形瓶,但无溶液溅出,溶液中部分Ti3+会被空气中的氧气氧化,会导致FeCl3 标准溶液消耗量偏少,会导致测定结果偏低;
所以操作会导致测定结果偏低的是bc,
故选bc.
点评 本题以铁及其化合物为载体考查了物质的制备,涉及氧化还原反应、实验操作、反应速率的影响因素等知识点,根据物质之间的关系式、实验操作的规范性、影响反应速率的因素等知识点来分析解答,题目难度中等.

 ;在上述由SiCl4气体制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g);△H=+0.025akJ•mol-1.
;在上述由SiCl4气体制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g);△H=+0.025akJ•mol-1.