题目内容
8.甲、乙、丙均是常见元素构成的化合物.已知甲、乙、丙均不含结晶水,含化合物甲的矿物是工业上电解法冶炼某种常见金属单质的原料,经检测甲是一种高熔点化合物,能溶于强酸、强碱溶液;化合物乙是光导纤维的主要成分;化合物丙为一种呈深蓝色的碱式盐,将34.6g丙隔绝空气加热分解生成24g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96g/L)和水.生成的Y折合成标准状况下的体积为4.48L.固体X难溶于水,能溶于硫酸,形成蓝色溶液.请回答下列问题:(1)写出气体Y的电子式
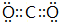 ,Y可形成分子晶体.过量的Y与氢氧化钠反应后的丁溶液与甲和氢氧化钠反应后的戊溶液发生的离子反应为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-.
,Y可形成分子晶体.过量的Y与氢氧化钠反应后的丁溶液与甲和氢氧化钠反应后的戊溶液发生的离子反应为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-.(2)化合物丙的化学式2CuCO3•Cu(OH)2.
(3)工业上电解化合物甲制取金属单质的正极反应式为2O2-+4e-=O2 ↑.另外,工业上常用甲与焦炭、氯气共热生成化合物丁和CO,而丁仅由两种元素组成,请写出该反应的化学方程式并标出电子转移的方向和数目
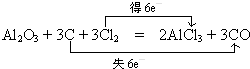 .
.(4)乙溶于氢氟酸后生成一种极强的二元酸和水.经分析该酸由3种元素组成,其中氟元素的质量分数为79.17%.请写出乙溶于氢氟酸的离子方程式SiO2+6HF=2H++SiF62-+2H2O.
(5)将固体X溶于适量的硫酸,往所得溶液中滴加NaOH浓溶液时,先出现蓝色絮状沉淀,继续滴加NaOH浓溶液并不断振荡,则沉淀消失形成蓝色溶液.综合以上信息可以说明蓝色絮状沉淀物具有两性(填化学性质).
分析 含化合物甲的矿物是工业上电解法冶炼某种常见金属单质的原料,经检测甲是一种高熔点化合物,能溶于强酸、强碱溶液,结合物质含有的元素,甲为Al2O3;化合物乙是光导纤维的主要成分,乙为SiO2;化合物丙为一种呈深蓝色的碱式盐,丙含有Cu元素,将34.6g丙隔绝空气加热分解生成24g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96g/L)和水,Y的摩尔质量为1.96g/L×22.4L/mol=44g/mol,考虑Y为CO2,固体X难溶于水,能溶于硫酸,形成蓝色溶液,为硫酸铜溶液,故X为CuO,即丙为碱式碳酸铜,生成的CO2折合成标准状况下的体积为4.48L,物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,根据碳元素守恒可知CuCO3为0.2mol,24gCuO的物质的量为$\frac{24g}{80g/mol}$=0.3mol,根据铜元素守恒Cu(OH)2为0.3mol-0.2mol=0.1mol,故碱式碳酸铜中n(CuCO3):n[Cu(OH)2]=0.2mol:0.1mol=2:1,故该碱式碳酸铜化学式为2CuCO3•Cu(OH)2,据此解答.
解答 解:含化合物甲的矿物是工业上电解法冶炼某种常见金属单质的原料,经检测甲是一种高熔点化合物,能溶于强酸、强碱溶液,结合物质含有的元素,甲为Al2O3;化合物乙是光导纤维的主要成分,乙为SiO2;化合物丙为一种呈深蓝色的碱式盐,丙含有Cu元素,将34.6g丙隔绝空气加热分解生成24g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96g/L)和水,Y的摩尔质量为1.96g/L×22.4L/mol=44g/mol,考虑Y为CO2,固体X难溶于水,能溶于硫酸,形成蓝色溶液,为硫酸铜溶液,故X为CuO,即丙为碱式碳酸铜,生成的CO2折合成标准状况下的体积为4.48L,物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,根据碳元素守恒可知CuCO3为0.2mol,24gCuO的物质的量为$\frac{24g}{80g/mol}$=0.3mol,根据铜元素守恒Cu(OH)2为0.3mol-0.2mol=0.1mol,故碱式碳酸铜中n(CuCO3):n[Cu(OH)2]=0.2mol:0.1mol=2:1,故该碱式碳酸铜化学式为2CuCO3•Cu(OH)2.
(1)气体Y为CO2,电子式为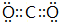 ,可以形成分子晶体,过量的Y与氢氧化钠反应后的丁溶液为碳酸氢钠溶液,甲和氢氧化钠反应后的戊溶液为偏铝酸钠溶液,二者发生的离子反应为:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-,
,可以形成分子晶体,过量的Y与氢氧化钠反应后的丁溶液为碳酸氢钠溶液,甲和氢氧化钠反应后的戊溶液为偏铝酸钠溶液,二者发生的离子反应为:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-,
故答案为: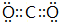 ;分子晶体;HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-;
;分子晶体;HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-;
(2)化合物丙的化学式2CuCO3•Cu(OH)2,
故答案为:2CuCO3•Cu(OH)2;
(3)工业上电解熔融氧化铝冶炼Al,正极发生还原反应,正极反应式为2O2-+4e-=O2↑.工业上常用Al2O3与焦炭、氯气共热生成化合物丁和CO,而丁仅由两种元素组成,由元素守恒可知丁为AlCl3,反应方程式为Al2O3+3C+3Cl2$\frac{\underline{\;高温\;}}{\;}$3CO+2AlCl3,C元素化合价由0价升高为+2,失去电子数为6,氯元素化合价由0价降低为-1价,获得电子数目为6,标出电子转移的方向和数目为: ;
;
故答案为:2O2-+4e-=O2 ↑; ;
;
(4)SiO2溶于氢氟酸后生成一种极强的二元酸和水,该酸由3种元素组成,其中氟元素的质量分数为79.17%,分子中H原子数目为2,令该酸的化学式为:H2SixFy,根据化合价代数和为0可知2+4x-y=0,由氟元素质量分数有$\frac{19y}{2+28x+19y}$=79.17%,联立解得x=1,y=6,故该酸为H2SiF6,故SiO2溶于氢氟酸的离子反应方程式为:SiO2+6HF=2H++SiF62-+2H2O;
故答案为:SiO2+6HF=2H++SiF62-+2H2O;
(5)将固体CuO溶于适量的硫酸,往所得溶液中滴加NaOH浓溶液时,先出现蓝色絮状沉淀,为Cu(OH)2,继续滴加NaOH浓溶液并不断振荡,则沉淀消失形成蓝色溶液,说明Cu(OH)2具有酸性,由于氢氧化铜属于碱,可以说明Cu(OH)2具有两性,
故答案为:两性.
点评 本题考查无机物推断,涉及元素单质及化合物性质推断、化学计算推断,难度较大,是对所学知识的综合运用,旨在考查学生的推理思维能力.

| A | 2使溴的四氯化碳溶液褪色; ②比例模型为 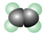 ③能与水在一定条件下反应生成C |
| B | 2C、H两种元素组成; ②球棍模型为  |
| C | ①由C、H、O三种元素组成; ②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2; ②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成;②其水溶液能使紫色石蕊试液变红; ③可由C发生氧化反应得到 |
(2)A能使溴的四氯化碳溶液褪色,该化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(3)C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(4)有机物B具有的性质是②③(填序号)①无色无味的溶液 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色
(5)写出与C与Na反应的化学方程式2CH3CH2OH+2Na=2CH3CH2ONa+H2↑.
| A. | 非金属性:F>O>S | B. | 稳定性:PH3>H2S>HCl | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 酸性:HClO4>HBrO4>HIO4 |
| A. | 放电时,电子由Pb通过外电路转移到PbO2 | |
| B. | 充电时阴极反应:PbSO4+2e-=Pb(s)+SO42-(aq) | |
| C. | 充电时,电源的正极接铅蓄电池标“-”的一极 | |
| D. | “无液干粉”铅蓄电池中的电解质溶液不易发生泄漏 |
| A. | 酯化反应的反应物之一肯定是醇 | B. | 酯化反应一般不需要加热 | ||
| C. | 酯化反应是有限度的 | D. | 酯化反应一般需要催化剂 |
 ;元素Y在周期表中位于第ⅣA族.
;元素Y在周期表中位于第ⅣA族.

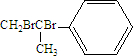 ,化合物Ⅱ完全燃烧消耗O211.5 mol.
,化合物Ⅱ完全燃烧消耗O211.5 mol. .化合物Ⅳ与新制Cu(OH)2反应的化学方程式
.化合物Ⅳ与新制Cu(OH)2反应的化学方程式 .
. .
. 能发生类似反应①的反应经两步生成化合物Ⅶ,Ⅶ的结构简式为
能发生类似反应①的反应经两步生成化合物Ⅶ,Ⅶ的结构简式为 .
.