题目内容
19.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.(1)M2-的离子结构示意图为
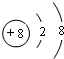 ;元素Y在周期表中位于第ⅣA族.
;元素Y在周期表中位于第ⅣA族.(2)X、M两种元素能形成X2M2型化合物,该化合物所含的化学键类型离子键、共价键.
(3)W和Z的最高价氧化物对应的水化物的酸性较强的是HClO4(写化学式).Y和Z的气态氢化物的稳定性较弱的是SiH4(写化学式).
(4)用电子式表示XW的形成过程

(5)X、Y、Z、W四种元素的原子半径从大到小的顺序是Na>Si>S>Cl(用元素符号表示).
分析 X、Y、Z、W、M五种短周期元素,Y的单质晶体熔点高、硬度大,是一种重要的半导体材料,可知Y为Si;X、Y、Z、W同周期,都处于第三周期,由X+与M2-具有相同的电子层结构,可知X为Na、M为O;Z、M同主族,则Z为S;离子半径Z2->W-,则W为Cl,据此解答.
解答 解:X、Y、Z、W、M五种短周期元素,Y的单质晶体熔点高、硬度大,是一种重要的半导体材料,可知Y为Si;X、Y、Z、W同周期,都处于第三周期,由X+与M2-具有相同的电子层结构,可知X为Na、M为O;Z、M同主族,则Z为S;离子半径Z2->W-,则W为Cl.
(1)O2-的离子结构示意图为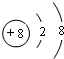 ;Y为Si元素,在周期表中位于第ⅣA族,
;Y为Si元素,在周期表中位于第ⅣA族,
故答案为: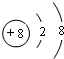 ;ⅣA;
;ⅣA;
(2)X、M两种元素能形成X2M2型化合物为Na2O2,钠离子与过氧根离子形成的离子键,过氧根中存在O-O非极性共价键,故答案为:离子键、共价键;
(3)非金属性Cl>S,故酸性:HClO4>H2SO4,非金属性S>Si,故氢化物稳定性H2S>SiH4,
故答案为:HClO4;SiH4;
(4)用电子式表示NaCl的形成过程为: ,
,
故答案为: ;
;
(5)同周期自左而右原子半径减小,故原子半径:Na>Si>S>Cl,
故答案为:Na>Si>S>Cl.
点评 本题考查位置结构性质关系应用,“Y是种重要的半导体材料、X+与M2-具有相同的电子层结构”是推断突破口,侧重对元素周期律的考查,注意对基础知识的积累掌握,难度不大.

练习册系列答案
相关题目
10.相同温度和压强下,在容积为2L的密闭容器中发生反应:2HI(g)?H2(g)+I2(g),达到平衡状态的标志是( )
| A. | c(H2)保持不变 | |
| B. | c(H2)=c(I2) | |
| C. | 2v正(HI)=v逆(I2) | |
| D. | 拆开2 mol H-I共价键,同时生成1 mol H-H共价键 |
7.下列各组物质中,互为同系物的是( )
| A. | C2H6和C2H4 | B. | CH3CH2Cl和CH3CH2CH2CCl3 | ||
| C. | CH3CH2CH3和C5H12 | D. | CH3CH2CH2OH和HOCH2CH2OH |
14.下列有关物质的性质,说法正确的是( )
| A. | SiO2既能与氢氟酸反应,又能与烧碱反应,所以它是两性氧化物 | |
| B. | Cl2、SO2都能使紫色石蕊试液与品红溶液褪色 | |
| C. | 相同质量的Cu分别与过量的体积相同的浓硝酸、稀硝酸反应,反应中铜失去的电子数相等 | |
| D. | 32g Cu与50mL 18.4mol/L的硫酸溶液共热,充分反应后,被还原的H2SO4为0.46mol |
4.在实验室中,下列除杂的方法正确的是( )
| A. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴 | |
| B. | 乙烷中混有乙烯,通H2在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有浓H2SO4和浓HNO3,将其倒入NaOH溶液中,静置,分液 | |
| D. | 乙烯中混有CO2和SO2,将其通过盛有NaOH溶液的洗气瓶 |
11.有机物A的结构如右图所示,下列有关判断,正确的是( )
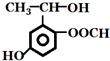

| A. | 1mol该有机物最多能与含2mol Br2的水溶液反应 | |
| B. | A的核磁共振氢谱图上有7个吸收峰 | |
| C. | A能发生银镜反应和酯化反应 | |
| D. | 与足量NaOH溶液反应转变成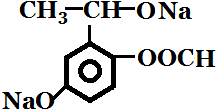 |
9.生活中有很多现象与化学的关系密不可分,请问下列解释不科学的是( )
| A. | “水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性Ca(HCO3)2的缘故 | |
| B. | 长期盛放NaOH溶液的试剂瓶不易打开,是因为NaOH与瓶中的CO2反应导致瓶内气体减少形成负压的缘故 | |
| C. | 严格地讲,实验室使用”通风橱”防污染是不负责任的,因为实验产生的有害气体没有得到转化或吸收 | |
| D. | “雨后彩虹”与“海市蜃楼”都是自然界的光学现象,也与胶体知识有关 |
 ,沸点196.5℃.请回答下列问题:
,沸点196.5℃.请回答下列问题: 的沸点>196.5℃.(填“>”、“<”或“=”)原因是
的沸点>196.5℃.(填“>”、“<”或“=”)原因是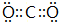 ,Y可形成分子晶体.过量的Y与氢氧化钠反应后的丁溶液与甲和氢氧化钠反应后的戊溶液发生的离子反应为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-.
,Y可形成分子晶体.过量的Y与氢氧化钠反应后的丁溶液与甲和氢氧化钠反应后的戊溶液发生的离子反应为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-.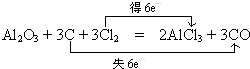 .
.