题目内容
【题目】金属锰在冶金工业中用来制造特种钢,常作为脱硫剂和去氧剂,其化合物广泛应用于电池、机械制造业等领域。
(1)以软锰矿(主要为MnO2)为原料通过热还原法得到金属锰涉及的两个反应:
①3MnO2(s)=Mn3O4(s)+ O2(g) △H1= akJmol-1
②3Mn3O4(s)+ 8Al(s) =4Al2O3(s) + 9Mn(s) △H2= bkJmol-1
已知Al的燃烧热为 △H3=ckJmol-1,则MnO2与Al发生铝热反应的热化学方程式为___________。
(2)科研人员将制得的锰粉碎后加入到SnCl2溶液中使其浸出(假定杂质不反应,溶液 体积不变),发生反应Mn(s)+ Sn2+(aq)![]() Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
请回答下列问题:
①为加快反应速率可以采取的措施有__________;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是____________________。
②下列能说明反应已达平衡的有____________________(填编号)。
A.溶液的颜色不发生变化 B.溶液中c(Mn2+)=c( Sn2+)
C.体系中固体的质量不变 D.Mn2+与Sn2+浓度的比值保持不变
③室温下,测得溶液中阳离子浓度c(R2+)随时间的变化情况如下图所示,则上述反应的平衡常数K=________________,Mn2+的产率为____________。
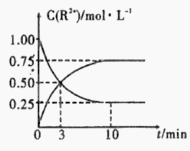
④若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则 再次平衡时c(Mn2+) =____________(不考虑离子水解的影响)。
(3)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为_____________________,阳极附近溶液的pH____________(选填“增大”、“减小”或“不变”)。
【答案】![]() 升高温度或增大c(Sn2+) 构成多个微型原电池,加快反应速率 ACD 3 75% 0.375molL-1
升高温度或增大c(Sn2+) 构成多个微型原电池,加快反应速率 ACD 3 75% 0.375molL-1 ![]() 减小
减小
【解析】
(1)Al的燃烧热为 △H3=ckJmol-1,则铝的燃烧反应的热化学方程式为:③![]() ,根据盖斯定律计算(①×3+②+③)×
,根据盖斯定律计算(①×3+②+③)×![]() 得到MnO2与Al发生铝热反应的热化学方程式:
得到MnO2与Al发生铝热反应的热化学方程式:![]() ;
;
(2)①通过升高温度或增大反应物浓度可使化学反应速率加快;因Mn与Sn的金属活泼性不同,析出的Sn附着在Mn表面,溶液中存在能够自由移动的离子,从而构成了原电池,使得Mn的溶解速率加快,故答案为:升高温度或增大c(Sn2+);构成多个微型原电池,加快反应速率;
②A.该体系中只有Sn2+具有颜色,若溶液的颜色不发生变化,则说明溶液中c(Sn2+)不变,能够说明反应达到了平衡状态,故A符合题意;
B.因不确定起始Sn2+浓度以及其转化率,因此达到平衡状态时,无法确定c(Mn2+)与c(Sn2+)关系,故不能判断反应是否处于平衡状态,故B不符合题意;
C.反应中固体质量在不断发生变化,若体系中固体的质量不变,说明溶液中离子浓度不变,能够说明反应达到平衡状态,故C符合题意;
D.随着反应的进行,Mn2+与Sn2+浓度在不断变化,当Mn2+与Sn2+浓度的比值保持不变时,说明正逆反应速率相同,反应达到平衡状态,故D符合题意;
故答案为:ACD;
③随着反应的进行,c(Sn2+)逐渐减小,c(Mn2+)逐渐增加,由此可知,平衡状态下c(Mn2+)=0.75mol/L,c(Sn2+)=0.25mol/L,平衡常数 ;Mn2+理论产量为Sn2+完全转化时的生成量,由此Mn2+的产量为
;Mn2+理论产量为Sn2+完全转化时的生成量,由此Mn2+的产量为![]() ;
;
④若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,c(Mn2+)、c(Sn2+)均变为原来的一半,平衡不发生移动,由此再次平衡时![]() ;
;
(3)由题可知,该体系中Mn元素化合价升高,电解质溶液为酸性,由此阳极上发生的电极反应式为:![]() ;阳极附近生成了H+,溶液的pH将减小。
;阳极附近生成了H+,溶液的pH将减小。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】(1)无机化合物可根据其组成和性质进行分类:
ⅰ、下图所示的物质分类方法名称是________。
ⅱ、以Na、K、H、O、C、S中任意两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl ② __ | ③ __ ④ Ba(OH)2 | ⑤ Na2CO3 ⑥ ___ | ⑦ CO2 ⑧ H2O |
ⅲ、 写出⑦通入到过量的④溶液中的离子方程式:_________。
ⅳ、 实验室检验气态⑧的方法是___________。
(2)某无色透明溶液,跟金属铝反应放出H2,判断下列离子:Mg2+、Ba2+、Cu2+、H+、Ag+、SO42-、SO32-、OH-、HCO3-、NO3-,哪种离子能大量存在于此溶液中。
ⅰ、 生成Al3+时,原无色透明溶液能够大量存在的离子有_______。
ⅱ、生成AlO2-时,原无色透明溶液能够大量存在的离子有_____。