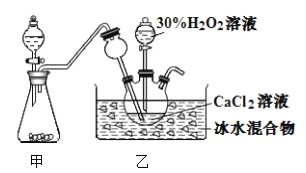
题目内容
【题目】下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下:

回答下列问题:
(1)A是:____________, I是:____________(填化学式);
(2)按要求写出下列反应的方程式:
Ⅰ.①的化学方程式:______________________________;
Ⅱ.②的化学方程式(同时用双线桥法表示该反应的电子转移情况):________________;
Ⅲ. J与过量的澄清石灰水反应的离子方程式:______________________________。
【答案】Na CO2 2Na+2H2O=2NaOH+H2↑ 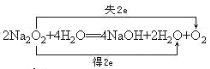 (或写成“2×e-”) HCO3-+Ca2++OH-=CaCO3↓+H2O
(或写成“2×e-”) HCO3-+Ca2++OH-=CaCO3↓+H2O
【解析】
A、B、C三种单质,A的焰色反应为黄色,A是Na;钠元素主要以氯化钠形式存在于海水中,G是氯化钠;F是一种淡黄色的固体,F是Na2O2;H是一种常见的无色液体,H是水;I是造成温室效应的“元凶”,I是CO2。根据流程图,钠与单质C生成氯化钠,C是氯气;钠与B单质生成过氧化钠,B是氧气;钠与水反应生成氢氧化钠,D是氢氧化钠,氢氧化钠与二氧化碳反应生成碳酸钠,K是碳酸钠;碳酸氢钠加热分解为碳酸钠,J是碳酸氢钠;碳酸氢钠与盐酸反应生成氯化钠,L是盐酸。
(1)A、B、C三种单质,A的焰色反应为黄色,A是Na;I是造成温室效应的“元凶”,I是CO2。;
(2)Ⅰ.反应①是钠与水反应生成氢氧化钠和氢气,反应的化学方程式为2Na+2H2O=2NaOH+H2↑;
Ⅱ.F是过氧化钠,反应②是过氧化钠与水反应生成氢氧化钠和氧气,反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑,反应的实质是Na2O2和H2O发生复分解反应生成氢氧化钠和过氧化氢,过氧化氢分解为水和氧气,水既不是氧化剂又不是还原剂,氢氧化钠既不是氧化产物又不是还原产物,过氧化钠中氧元素化合价既升高又降低,用双线桥法表示该反应的电子转移为 ;
;
Ⅲ. J是碳酸氢钠,与过量的澄清石灰水反应生成碳酸钙沉淀、氢氧化钠、水,反应的离子方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O。

【题目】X溶液中含有下表所示离子中的某5种,且其离子浓度均为![]() (不考虑水的电离和离子水解)。向X溶液中加入足量稀盐酸,有气体生成,反应前后阴离子种类不变。下列叙述错误的是( )
(不考虑水的电离和离子水解)。向X溶液中加入足量稀盐酸,有气体生成,反应前后阴离子种类不变。下列叙述错误的是( )
阳离子 |
|
阴离子 |
|
A.原溶液中一定含有![]()
B.X溶液中不可能含有![]() 和
和![]()
C.X溶液中含有3种阳离子、2种阴离子
D.生成气体的离子反应方程式为![]()