题目内容
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量的铝铁合金与1000mL一定浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4.00mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
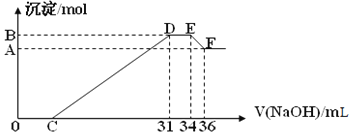
(1)原混合物中铝粉与铁粉的物质的量之比为______
(2)硝酸溶液的物质的量浓度为______molL-1
【答案】1:3 0.148
【解析】
(1)E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中,其反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O,氢氧化铝与氢氧化钠物质的量之比为1:1,EF段的n(NaOH)=4mol/L×2×10-3L=0.008mol,
Al——Al(OH)3——NaOH→NaAlO2+2H2O
1 1
0.008mol 0.008mol
所以铝的物质的量为0.008mol;
D与E一段氢氧化钠被消耗,DE段是NH4NO3和NaOH反应
NH4NO3~NaOH
1 1
n(NH4NO3)=n(NaOH)=(34-31)×10-3L×4mol/L=0.012mol,
设铁有x mol,Al离子也是0.008mol,NH4+有0.012mol,根据电子守恒可得:3x+0.008×3=0.012×8,x=0.024mol,所以铁离子有0.024mol,根据原子守恒知,铁的物质的量是0.024mol,故原混合物中铝粉与铁粉的物质的量之比为0.008mol:0.024mol=1:3,故答案为:1:3;
(2)E点时,溶液中的溶质是硝酸钠和氨水,n(NH3H2O)=n(NH4+)=0.012mol,n(NaNO3)=n(NaOH)=34×10-3L×4mol/L=0.136mol,根据氮原子守恒知,c(HNO3)=0.148mol/L,故答案为:0.148。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案