题目内容
【题目】(1)无机化合物可根据其组成和性质进行分类:
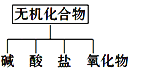
ⅰ、下图所示的物质分类方法名称是________。
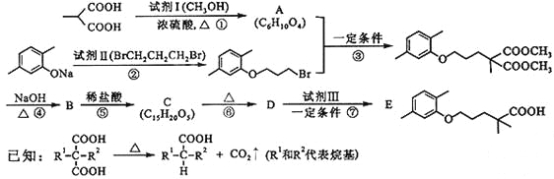
ⅱ、以Na、K、H、O、C、S中任意两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl ② __ | ③ __ ④ Ba(OH)2 | ⑤ Na2CO3 ⑥ ___ | ⑦ CO2 ⑧ H2O |
ⅲ、 写出⑦通入到过量的④溶液中的离子方程式:_________。
ⅳ、 实验室检验气态⑧的方法是___________。
(2)某无色透明溶液,跟金属铝反应放出H2,判断下列离子:Mg2+、Ba2+、Cu2+、H+、Ag+、SO42-、SO32-、OH-、HCO3-、NO3-,哪种离子能大量存在于此溶液中。
ⅰ、 生成Al3+时,原无色透明溶液能够大量存在的离子有_______。
ⅱ、生成AlO2-时,原无色透明溶液能够大量存在的离子有_____。
【答案】树状分类法 H2SO4 或H2SO3 或H2CO3或H2S或H2C2O4(合理即可) NaOH或 KOH K2CO3或K2SO3或K2SO4或Na2SO3或Na2SO4(合理即可) Ba2++2OH-+CO2 = BaCO3↓+H2O 将该气体通入无水硫酸铜固体中,若无水硫酸铜变蓝色,则证明该气体为H2O Mg2+、H+、SO42- Ba2+、OH-、NO3-
【解析】
(1)i、根据交叉分类法和树状分类法的定义分析判断;
ii、以Na、K、H、O、C、S六种元素中任意两种或三种元素可组成酸、碱、盐、氧化物等,根据常见的物质的化学式书写;
ⅲ、 ⑦CO2通入到过量的④[Ba(OH)2]溶液中反应生成碳酸钡沉淀,据此书写反应的离子方程式;
ⅳ、 实验室常用无水硫酸铜固体检验水蒸气;
(2)溶液无色,则一定不存在有色的Fe3+离子,与铝反应生成氢气,则溶液中存在大量氢离子或氢氧根离子。i、当生成Al3+时,说明溶液呈酸性;ii、当生成AlO2-时,说明溶液呈碱性,据此分析解答。
(1)ⅰ、交叉分类法是根据物质不同的分类标准,对同一事物进行多种分类的一种分类方式,树状分类法是对同一类事物按照某些属性进行在分类的分类法,无机化合物可根据其组成和性质进行分类:无机化合物、盐、碱、酸、氧化物、氢化物属于树状分类法,故答案为:树状分类法;
ⅱ、以Na、K、H、O、C、S六种元素中任意两种或三种元素可组成酸有:H2SO4、H2CO3、H2SO3 、H2CO3、H2S或H2C2O4,碱有:NaOH、KOH,盐有:K2CO3、Na2CO3、K2SO3、Na2SO3、K2SO4、Na2SO4,故答案为:H2SO4 或H2SO3 或H2CO3或H2S或H2C2O4;NaOH或KOH;K2CO3或K2SO3或K2SO4或Na2SO3或Na2SO4;
ⅲ、 ⑦CO2通入到过量的④[Ba(OH)2]溶液中反应生成碳酸钡沉淀,反应的离子方程式为Ba2++2OH-+CO2 = BaCO3↓+H2O,故答案为:Ba2++2OH-+CO2 = BaCO3↓+H2O;
ⅳ、 实验室常用无水硫酸铜固体检验水蒸气,方法为将该气体通入无水硫酸铜固体中,若无水硫酸铜变蓝色,则证明该气体为H2O,故答案为:将该气体通入无水硫酸铜固体中,若无水硫酸铜变蓝色,则证明该气体为H2O;
(2)无色透明溶液,说明原溶液中不存在Cu2+;铝既能与酸作用产生氢气,也能与碱作用产生氢气。
ⅰ、当溶液显酸性时,铝与酸反应生成Al3+,溶液显酸性,则SO32-、HCO3-、OH-不能大量存在,由于硝酸与金属反应一般没有氢气产生,因此也不存在NO3-;根据溶液不显电性,一定存在阴离子,即溶液中肯定有SO42-,而Ag+、Ba2+可与SO42-生成沉淀,说明原溶液中也不存在Ag+、Ba2+,此时溶液中一定含H+、SO42-,可能存在Mg2+离子,故答案为:H+、SO42-、Mg2+;
ⅱ、当溶液显碱性时,铝与碱反应生成AlO2-,在碱性溶液中Mg2+、Cu2+、H+、Ag+、HCO3-不能大量存在,根据溶液不显电性,一定存在阳离子,一定含有Ba2+,根据离子共存可知原溶液中的阴离子只能是OH-、NO3-,则原溶液中一定存在的离子为OH-、Ba2+,可能存在NO3-,故答案为:OH-、Ba2+、NO3-。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案