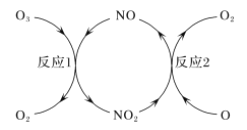
题目内容
【题目】用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O42H2O)的工业流程如图。已知:①草酸钴晶体难溶于水,②RH为有机物(难电离)
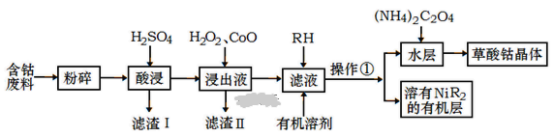
(1)滤渣I的主要成分是_____________(填化学式) ,写出两种能提高酸浸速率的措施_____________ 、 ___________。
(2) 操作①用到的主要仪器有___________________。
(3) H2O2是种绿色氧化剂,写出加入H2O2后发生反应的离子方程式________________________________________。
(4)加入氧化钴的目的是______________________________。
(5)加入(NH4)2C2O4反应得到草酸钴晶体的离子方程式________________________________,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验是否洗涤干净的方法是__________________________________________。
(6)实验室可以用酸性KMnO4标准液滴定草酸根离子(C2O42-) ,测定溶液中C2O42-的浓度, KMnO4标准溶液常用硫酸酸化,若用盐酸酸化,会使测定结果___________(填“偏高”、“偏低“或“无影响”)。
【答案】SiO2 增大硫酸的浓度 提高反应的温度、搅拌、将固体粉碎(任选两个) 分液漏斗、烧杯 ![]() 调节pH
调节pH ![]() 取最后一次的洗涤液少许于试管中,滴入盐酸酸化的氯化钡溶液,若无沉淀生成,则证明洗涤干净 偏高
取最后一次的洗涤液少许于试管中,滴入盐酸酸化的氯化钡溶液,若无沉淀生成,则证明洗涤干净 偏高
【解析】
用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O42H2O):粉碎后用硫酸溶解,SiO2不与硫酸反应,过滤得到滤液中含有CoSO4、NiSO4、FeSO4、Al2(SO4)3及过量的硫酸,滤渣Ⅰ为SiO2,滤液中加入过氧化氢和CoO,将Fe2+氧化为Fe3+,同时调节pH,使铁离子、铝离子转化为沉淀除去,所以滤渣Ⅱ为氢氧化铁、氢氧化铝,向滤液中加入RH,Ni2+溶于有机层,操作①为分液,向水层加入(NH4)2C2O4,得到草酸钴晶体,以此来解答。
(1)用含钴废料,粉碎后用硫酸溶解,SiO2不与硫酸反应,滤渣Ⅰ为SiO2;提高硫酸的浓度、提高反应的温度、搅拌、将固体粉碎均能提高酸浸速率;
(2)通过操作①得到水层和有机层,则操作①为分液,分液需要的仪器有:分液漏斗、烧杯;
(3)H2O2氧化亚铁离子生成铁离子,离子方程式为:![]() ;
;
(4)加入氧化钴的目的是调节溶液的pH,将浸出液中Fe3+和Al3+全部沉淀;
(5)加入(NH4)2C2O4反应的离子方程式为:![]() ,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验是否洗涤干净的方法是:取最后一次的洗涤液少许于试管中,滴入盐酸酸化的氯化钡溶液,若无沉淀生成,则证明洗涤干净;
,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验是否洗涤干净的方法是:取最后一次的洗涤液少许于试管中,滴入盐酸酸化的氯化钡溶液,若无沉淀生成,则证明洗涤干净;
(6)若用盐酸酸化,高锰酸钾会氧化盐酸中的氯离子,消耗高锰酸钾偏多,测定结果偏高。

【题目】X溶液中含有下表所示离子中的某5种,且其离子浓度均为![]() (不考虑水的电离和离子水解)。向X溶液中加入足量稀盐酸,有气体生成,反应前后阴离子种类不变。下列叙述错误的是( )
(不考虑水的电离和离子水解)。向X溶液中加入足量稀盐酸,有气体生成,反应前后阴离子种类不变。下列叙述错误的是( )
阳离子 |
|
阴离子 |
|
A.原溶液中一定含有![]()
B.X溶液中不可能含有![]() 和
和![]()
C.X溶液中含有3种阳离子、2种阴离子
D.生成气体的离子反应方程式为![]()