题目内容
18.已知两种弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB).下列有关说法正确的是( )| A. | 等温浓度均为0.1 mol•L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB) | |
| B. | 在0.1mol•L-1的NaA溶液中各离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多 | |
| D. | 等温浓度均为0.1 mol•L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB) |
分析 弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB),则酸性HA>HB,等浓度时,HA电离程度较大,溶液c(H+)较大,对应的NaA、NaB中,NaB易水解,以此解答该题.
解答 解:弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB),HA酸性较强,
A.等温、浓度均为0.1mol•L-1的HA、HB溶液中,HA的c(H+)较大,pH较小,故A错误;
B.NaA为强碱弱酸盐,水解呈碱性,溶液中离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+),故B正确;
C.等体积pH相同的HA、HB溶液,因HB较弱,则HB浓度较大,物质的量较多,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB少,故C错误;
D.NaB易水解,等温浓度均为0.1mol•L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)<pH(NaB),故D错误.
故选B.
点评 本题考查了弱电解质的电离,为高频考点,侧重于学生的分析能力的考查,明确电离平衡常数与酸性强弱、酸根离子水解程度大小之间的关系是解本题关键,题目难度不大.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
12.锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3•H2O═Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O.
请回答下列问题.
(1)上述方程式中涉及到的N、O元素电负性由小到大的顺序是N<O.
(2)基态S的价电子排布式为3s23p4.与Cu同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是,其中P原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量的KCN溶液,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键的数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm(1pm=10-10cm),列式计算晶体铜的密度9.0g/cm3.
(6)下表列出了含氧酸酸性强弱与非羟基氧原子数的关系.
由此可得出的判断含氧酸强弱的一条经验规律是含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.亚磷酸(H3PO3)也是中强酸,它的结构式为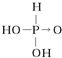 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
请回答下列问题.
(1)上述方程式中涉及到的N、O元素电负性由小到大的顺序是N<O.
(2)基态S的价电子排布式为3s23p4.与Cu同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是,其中P原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量的KCN溶液,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键的数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm(1pm=10-10cm),列式计算晶体铜的密度9.0g/cm3.
(6)下表列出了含氧酸酸性强弱与非羟基氧原子数的关系.
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 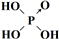 | 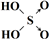 | 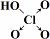 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
13.一种饱和一元醛和一种烯烃形成的混合物,经测定其中含氧的质量分数为a,则该混合物中含氢的质量分数为( )
| A. | $\frac{b(1-a)}{7}$ | B. | $\frac{1-a}{7}$ | C. | $\frac{a}{8}$ | D. | 无法确定 |
6.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 常温常压下,32gO2和32gO3所含氧原子数都是NA | |
| C. | 1molFe与足量盐酸反应,转移电子数为3NA | |
| D. | 标准状况下36g H2O中原子的数目为6NA |
8.下列元素中,属于第三周期的是( )
| A. | C | B. | K | C. | S | D. | Ca |
 CH3COOC2H5+H2O
CH3COOC2H5+H2O