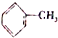
题目内容
10.已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大.X元素原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍.(1)写出元素名称:X氢;Y碳;Z氮;W氧.
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(注明反应条件)N2+3H2$?_{加热、加压}^{催化剂}$2NH3;E分子空间构形为三角锥形.
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥,但长期施用会使土壤酸化,有关的离子方程式为NH4++H2O?NH3•H2O+H+.
分析 X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大,X元素原子形成的离子就是一个质子,则X是H元素;Y原子的最外层电子数是内层电子数的2倍,最外层电子不能超过8,只能有2个电子层,最外层电子数为4,则Y是C元素;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,且Z的原子序数小于W,所以Z是N元素,W是O元素,据此解答.
解答 解:X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大,X元素原子形成的离子就是一个质子,则X是H元素;Y原子的最外层电子数是内层电子数的2倍,最外层电子不能超过8,只能有2个电子层,最外层电子数为4,则Y是C元素;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,且Z的原子序数小于W,所以Z是N元素,W是O元素,
(1)通过以上分析知,X、Y、Z、W分别是:氢、碳、氮、氧,故答案为:氢;碳;氮;氧;
(2)氢气和氮气在一定条件下反应生成氨气,该反应的化学方程式为:N2+3H2$?_{加热、加压}^{催化剂}$2NH3;氨分子中的N是sp3杂化,所以氨气是三角锥形,故答案为:N2+3H2$?_{加热、加压}^{催化剂}$2NH3;三角锥形;
(3)由H、N、O三种元素组成的一种速效肥料盐是硝酸铵,铵根离子水解生成一水合氨和氢离子,溶液显示酸性,水解的离子方程式为:NH4++H2O?NH3•H2O+H+,
故答案为:NH4++H2O?NH3•H2O+H+.
点评 本题考查了位置结构与性质关系的综合应用,题目难度中等,根据所学知识及题干信息正确推断各元素名称为解答关键,注意掌握常见化学用语的概念及书写方法,明确元素周期表结构、元素周期律内容为解答此类题的基础.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
4.已知A、B、C、D、E五种短周期元素的原子序数依次增大;D的核电荷数是B的核电荷数的$\frac{4}{3}$倍;A分别能与B、C、D形成电子数相等的分子X、Y、Z;E与B同主族.下列说法中不正确的是( )
| A. | Z分子中各原子共平面 | |
| B. | A、C形成的5核10电子的阳离子能破坏水的电离平衡 | |
| C. | B、E两元素的最高价氧化物对应的水化物的酸性是后者强 | |
| D. | 由X、D2、NaOH溶液和惰性电极组成的燃料电池中,负极通入的是X |
18.已知两种弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB).下列有关说法正确的是( )
| A. | 等温浓度均为0.1 mol•L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB) | |
| B. | 在0.1mol•L-1的NaA溶液中各离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多 | |
| D. | 等温浓度均为0.1 mol•L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB) |
5.下列离子方程式的书写中,正确的是( )
| A. | 硫酸亚铁溶液与过氧化氢溶液混合Fe2++2H2O2+4H+═Fe3++4H2O | |
| B. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 大理石溶解于醋酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | NH4HCO3溶液与足量NaOH溶液混合:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O |
15.100mL浓度为2mol•L-1的盐酸跟过量的锌片反应,为加快反应速率,下列措施不可行的是( )
| A. | 加入适量的6 mol•L-1的盐酸 | B. | 加入适量蒸馏水 | ||
| C. | 加热 | D. | 用锌粉替代锌片 |
2.关于分子模型①和②所代表的有机物(只含C、H、O三种元素),下列说法不正确的是( )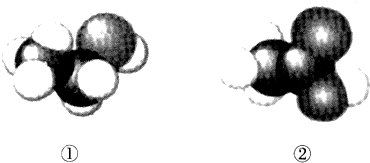

| A. | 二者互为同系物 | B. | 均易溶于水 | ||
| C. | 均能与金属钠反应生成氢气 | D. | 可用紫色石蕊溶液鉴别 |
20.某化学小组合作研究Cl2、Fe3+、Br2的氧化性强弱的顺序.
(1)甲同学根据已有知识,设计并进行下列实验:
①Cl2与NaBr溶液、FeCl2溶液与溴水反应的离子方程式分别为2Br-+Cl2═Br2+2Cl-、2Fe2++Br2=2Fe3++2Br-.
②由上述实验可知Cl2、Fe3+、Br2的氧化性强弱的顺序为Cl2>Br2>Fe3+.
(2)乙同学若用FeBr2溶液与Cl2进行实验,可以用一套装置完成上述实验目的,得出相同结论.乙同学设计并进行下列实验:
①B中反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
②开始通入100mL(折合标准状况)Cl2的目的是验证Cl2先氧化Fe2+.
(3)丙同学认为应对乙同学实验现象ⅰ、ⅱ所对应的溶液分别进行进一步验证,才能得出结论.
①丙同学另取100mLFeBr2溶液,通入100mL Cl2,振荡后,分别取2mL溶液于试管c和试管d中,进行实验,请完成下表:
②丙同学认为现象ⅱ中溶液变为棕黄色的原因是Cl2氧化Br-.丙同学设计实验进行验证,记录现象如下:
甲乙丙同学合作探究,证明了Cl2、Fe3+、Br2的氧化性强弱的顺序.
(1)甲同学根据已有知识,设计并进行下列实验:
| 试管 | 操作 | 现象 |
| a | 在试管中加入NaBr溶液,滴加少量氯水,用力振荡后,再加入少量CCl4,振荡静置 | CCl4层由无色逐渐变为橙红色 |
| b | ⅰ.在试管中加入FeCl2溶液,滴加两滴KSCN溶液 ⅱ.加入少量溴水,振荡 | ⅰ.浅绿色溶液无明显变化 ⅱ.溶液变为红色 |
②由上述实验可知Cl2、Fe3+、Br2的氧化性强弱的顺序为Cl2>Br2>Fe3+.
(2)乙同学若用FeBr2溶液与Cl2进行实验,可以用一套装置完成上述实验目的,得出相同结论.乙同学设计并进行下列实验:
| 操作 | A中现象 |
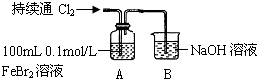 | ⅰ.开始通入100mL(折合标准状况)Cl2,溶液由浅绿色逐渐变黄 ⅱ.继续通入Cl2,溶液黄色加深,当变为棕黄色后,停止通入Cl2 |
②开始通入100mL(折合标准状况)Cl2的目的是验证Cl2先氧化Fe2+.
(3)丙同学认为应对乙同学实验现象ⅰ、ⅱ所对应的溶液分别进行进一步验证,才能得出结论.
①丙同学另取100mLFeBr2溶液,通入100mL Cl2,振荡后,分别取2mL溶液于试管c和试管d中,进行实验,请完成下表:
| 试管 | 操作 | 现象 |
| c | 滴加2-3滴KSCN溶液,振荡 | 溶液变为血红色 |
| d | 加入少量CCl4,振荡,静置 | 出现分层现象,下层为四氯化碳,且呈无色 |
| 试管 | 操作 | 现象 |
| e | 在试管中加入2mL棕黄色溶液,加入少量CCl4,振荡,静置 | CCl4层由无色变为橙红色 |
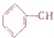 =CH2 D.
=CH2 D.