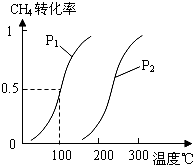
题目内容
13.图中A、B、C是常见的化学实验装置,请回答下列问题: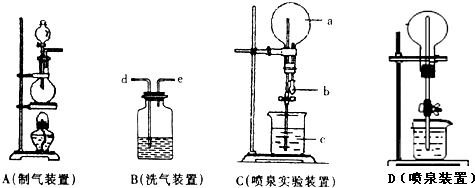
(1)实验里用A装置加热制取氯气,为得到纯净干燥的氯气,可让A中出来的气体在进入收集装置前依次分别通过装有饱和食盐水和浓硫酸的两个洗气瓶B,作用是分别除去氯气中的杂质HCl和H2O,
尾气应通入NaOH溶液,作用是吸收氯气防止污染环境,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,
(2)若C装置中圆底烧瓶a里充满了纯净、干燥的HCl气体,b、c为滴有石蕊试液的水,则引发水上喷的操作是打开止水夹,挤出胶头滴管中的水,该实验的原理是HCl极易溶于水,烧瓶内的压强迅速下降,外界大气压把水压入烧瓶.
(3)如果只提供如图D的装置,进行HCl的喷泉实验,请说明引发喷泉的方法:打开止水夹,用手(或热毛巾等)将烧瓶捂热,HCl受热膨胀赶出玻璃管内的空气,HCl
与水接触后迅速溶解,使烧瓶内压强减小,就能产生喷泉.
(4)若C装置中圆底烧瓶里充满了纯净、干燥的氯气,现用该装置做喷泉实验,则b、c中应盛的液体为氢氧化钠(写物质的名称)
分析 (1)实验里用A装置,加热二氧化锰和浓盐酸反应制取氯气,制得氯气中含有氯化氢和水蒸气,为得到纯净干燥的氯气,要通入饱和食盐水除去氯化氢,通过浓硫酸吸收水蒸气,氯气有毒是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收;
(2)喷泉实验利用的原理是压强差,;
(3)喷泉实验需形成明显的压力差;
(4)氯气形成喷泉的原理是由于氯气可溶于水,与氢氧化钠溶液反应,将胶体滴管内液体挤出,氯气和氢氧化钠溶液反应而导致烧瓶内压强迅速减小,从而形成喷泉,依据氯气形成喷泉的原理,如要形成喷泉,烧瓶内气体与胶头滴管内液体反应而导致烧瓶内压强减小,外界大气压将烧杯内液体压入到烧瓶内,从而形成喷泉.
解答 解:(1)用A装置在实验室制备氯气,原理是利用加热二氧化锰和浓盐酸反应制取氯气,制得氯气中含有氯化氢和水蒸气,为得到纯净干燥的氯气,要通入饱和食盐水除去氯化氢,通过浓硫酸吸收水蒸气,氯气有毒是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:饱和食盐水;浓硫酸;HCl;H2O;NaOH;吸收氯气防止污染环境;Cl2+2NaOH=NaCl+NaClO+H2O;
(2)氯化氢是一种极易溶于水的气体,将胶头滴管中的水挤入烧瓶中,瓶内压强减小,在外界气压的作用下,水被压到瓶内,形成喷泉现象,
故答案为:打开止水夹,挤出胶头滴管中的水;HCl极易溶于水,烧瓶内的压强迅速下降,外界大气压把水压入烧瓶;
(3)HCl是一种极易溶于水的气体,将胶头滴管中的水挤入烧瓶中,瓶内压强减小,在外界气压的作用下,水被压到瓶内,形成喷泉现象,
故答案为:打开止水夹,用手(或热毛巾等)将烧瓶捂热,HCl受热膨胀赶出玻璃管内的空气,与水接触后迅速溶解,使烧瓶内压强减小,就能产生喷泉;
(4)饱氢氧化钠溶液和氯气反应,将胶体滴管内液体挤出,氯气和氢氧化钠溶液反应而导致烧瓶内压强迅速减小,烧瓶内压强减小,能形成喷泉,b、c中应盛的液体为氢氧化钠溶液,
故答案为:氢氧化钠.
点评 本题考查喷泉实验的发生原理,物质性质和喷泉原理的理解应用,掌握基础是关键,题目难度不大,本题注意理解形成喷泉的条件.

 阅读快车系列答案
阅读快车系列答案| 编号 | 试验目的 | 操作 |
| ① | 比较水中氢和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与同温度的水和乙醇反应,观察反应快慢 |
| ② | 验证苯环上的氢原子能被溴原子所取代 | 向溴水中滴加苯,充分振荡,观察溴水层是否褪色 |
| ③ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中,观察溶液是否褪色 |
| ④ | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的PH |
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②④ |
| A. | 等温浓度均为0.1 mol•L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB) | |
| B. | 在0.1mol•L-1的NaA溶液中各离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多 | |
| D. | 等温浓度均为0.1 mol•L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB) |
| A. | 硫酸亚铁溶液与过氧化氢溶液混合Fe2++2H2O2+4H+═Fe3++4H2O | |
| B. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 大理石溶解于醋酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | NH4HCO3溶液与足量NaOH溶液混合:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O |
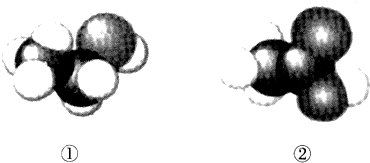
| A. | 二者互为同系物 | B. | 均易溶于水 | ||
| C. | 均能与金属钠反应生成氢气 | D. | 可用紫色石蕊溶液鉴别 |
| A. | “洁厕灵”(浓盐酸)与“84消毒液”(次氯酸钠)可以混和使用 | |
| B. | 工业上合成氨与实验室制氨气均属于氮的固定 | |
| C. | 由于铝表面有一层致密的氧化物薄膜,所以铝制容器可用来腌制咸菜 | |
| D. | 若铝钠合金投入一定量的水中得无色溶液,则合金中n(Al)≤n(Na) |
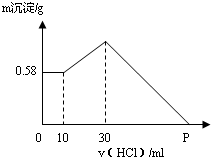 把NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中后,有0.58g白色沉淀,在所得浊液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示.试求:
把NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中后,有0.58g白色沉淀,在所得浊液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示.试求: