题目内容
8.下列元素中,属于第三周期的是( )| A. | C | B. | K | C. | S | D. | Ca |
分析 主族元素周期数等=电子层数,最外层电子数=族序数,由此确定元素的质子数,确定元素.
解答 解:A、碳的原子序数是6,第二周期元素,故A不选;
B、钾是19号元素,第四周期,故B不选;
C、硫是16号元素,第三周期,故C选;
D、钙是20号元素,第四周期,故D不选;
故选C.
点评 本题考查结构与位置的关系,难度不大,旨在考查学生的基础知识掌握情况,关键在于明确主族元素周期数等=电子层数,最外层电子数=族序数.

练习册系列答案
相关题目
18.已知两种弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB).下列有关说法正确的是( )
| A. | 等温浓度均为0.1 mol•L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB) | |
| B. | 在0.1mol•L-1的NaA溶液中各离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多 | |
| D. | 等温浓度均为0.1 mol•L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB) |
3.以下做法或判断合理的是( )
| A. | “洁厕灵”(浓盐酸)与“84消毒液”(次氯酸钠)可以混和使用 | |
| B. | 工业上合成氨与实验室制氨气均属于氮的固定 | |
| C. | 由于铝表面有一层致密的氧化物薄膜,所以铝制容器可用来腌制咸菜 | |
| D. | 若铝钠合金投入一定量的水中得无色溶液,则合金中n(Al)≤n(Na) |
20.某化学小组合作研究Cl2、Fe3+、Br2的氧化性强弱的顺序.
(1)甲同学根据已有知识,设计并进行下列实验:
①Cl2与NaBr溶液、FeCl2溶液与溴水反应的离子方程式分别为2Br-+Cl2═Br2+2Cl-、2Fe2++Br2=2Fe3++2Br-.
②由上述实验可知Cl2、Fe3+、Br2的氧化性强弱的顺序为Cl2>Br2>Fe3+.
(2)乙同学若用FeBr2溶液与Cl2进行实验,可以用一套装置完成上述实验目的,得出相同结论.乙同学设计并进行下列实验:
①B中反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
②开始通入100mL(折合标准状况)Cl2的目的是验证Cl2先氧化Fe2+.
(3)丙同学认为应对乙同学实验现象ⅰ、ⅱ所对应的溶液分别进行进一步验证,才能得出结论.
①丙同学另取100mLFeBr2溶液,通入100mL Cl2,振荡后,分别取2mL溶液于试管c和试管d中,进行实验,请完成下表:
②丙同学认为现象ⅱ中溶液变为棕黄色的原因是Cl2氧化Br-.丙同学设计实验进行验证,记录现象如下:
甲乙丙同学合作探究,证明了Cl2、Fe3+、Br2的氧化性强弱的顺序.
(1)甲同学根据已有知识,设计并进行下列实验:
| 试管 | 操作 | 现象 |
| a | 在试管中加入NaBr溶液,滴加少量氯水,用力振荡后,再加入少量CCl4,振荡静置 | CCl4层由无色逐渐变为橙红色 |
| b | ⅰ.在试管中加入FeCl2溶液,滴加两滴KSCN溶液 ⅱ.加入少量溴水,振荡 | ⅰ.浅绿色溶液无明显变化 ⅱ.溶液变为红色 |
②由上述实验可知Cl2、Fe3+、Br2的氧化性强弱的顺序为Cl2>Br2>Fe3+.
(2)乙同学若用FeBr2溶液与Cl2进行实验,可以用一套装置完成上述实验目的,得出相同结论.乙同学设计并进行下列实验:
| 操作 | A中现象 |
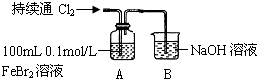 | ⅰ.开始通入100mL(折合标准状况)Cl2,溶液由浅绿色逐渐变黄 ⅱ.继续通入Cl2,溶液黄色加深,当变为棕黄色后,停止通入Cl2 |
②开始通入100mL(折合标准状况)Cl2的目的是验证Cl2先氧化Fe2+.
(3)丙同学认为应对乙同学实验现象ⅰ、ⅱ所对应的溶液分别进行进一步验证,才能得出结论.
①丙同学另取100mLFeBr2溶液,通入100mL Cl2,振荡后,分别取2mL溶液于试管c和试管d中,进行实验,请完成下表:
| 试管 | 操作 | 现象 |
| c | 滴加2-3滴KSCN溶液,振荡 | 溶液变为血红色 |
| d | 加入少量CCl4,振荡,静置 | 出现分层现象,下层为四氯化碳,且呈无色 |
| 试管 | 操作 | 现象 |
| e | 在试管中加入2mL棕黄色溶液,加入少量CCl4,振荡,静置 | CCl4层由无色变为橙红色 |
17.下列各组物质的性质顺序,不正确的是( )
| A. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 原子半径:Na<Mg<Al | D. | 熔点:SiO2>NaCl>CO2 |
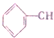 =CH2 D.
=CH2 D.