题目内容
10.海水中含有丰富的化学资源.食盐是海水中的重要资源,海水在浓缩过程中析出盐的种类和质量如表(单位g/L):| 海水密度(g/ml) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.022 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
(2)为了得到含较少杂质的粗盐,实际生产中卤水的密度控制在1.21-1.26范围之内.
(3)由上表可知先析出的物质是CaSO4.
(4)粗盐中常含有MgCl2、MgSO4和CaSO4等杂质,在实验室中依次加入abcd或bacd(填“序号”)等试剂,能将上述杂质除去.
a.BaCl2 b.NaOH c.Na2CO3 d.HCl.
分析 (1)依据氯化钠溶解度随温度变化不大,现代产盐常用太阳能蒸发法或盐田法;
(2)根据表中析出氯化钠时海水最小密度及海水密度与其它杂质的含量关系进行判断;
(3)溶解度越小,在溶液中蒸发过程中越容易析出;
(4)SO42-、Ca2+、Mg2+离子分别转化为硫酸钡、碳酸钙、氢氧化镁沉淀而除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的盐酸溶液.
解答 解:(1)氯化钠溶解度随温度变化不大,蒸发溶剂的方法得当氯化钠晶体,现代产盐常用太阳能蒸发法或盐田法,
故答案为:盐田法(或太阳能蒸发法);
(2)析出NaCl的最小卤水密度1.21g/L,且小于1.21g/L时有一定量的CaSO4析出;随着密度的增大NaCl析出量的变化,由于在密度1.21g/L~1.26 g/L之间NaCl已经大部分析出,当近一步浓缩时NaCl的析出量已经不多,而此时其他盐类的析出量在明显增加,这样会使食盐中杂质含量升高;所以控制在1.26 g/L以内,
故答案为:1.21-1.26;
(3)溶液在蒸发过程中,溶解度越小,越容易析出,当海水密度达到1.13g/mL时,由于硫酸钙的溶解度最小,则首先析出的盐是CaSO4,
故答案为:CaSO4;
(4)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后过滤后加入盐酸,氢氧化钠溶液加在过滤之前即可,所以正确顺序为:BaCl2、NaOH、Na2CO3、HCl或NaOH、BaCl2、Na2CO3、HCl,加入试剂顺序为:abcd或bacd;
故答案为:abcd或bacd.
点评 本题考查了海水资源的综合利用,题目难度中等,涉及溶液性质、溶解度、化学方程式、离子方程式书写等知识,试题知识点较多、综合性较强,考查比较全面,充分培养了学生的分析、理解能力及灵活应用能力,(4)为易错点,注意加入试剂的先后顺序.

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
| A. | CH3COOH | B. | NaCl | C. | HCl | D. | Na2CO3 |
| A. | 氯酸钾溶液 | B. | 次氯酸钠溶液 | C. | 液氯 | D. | 氯水 |
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 | ②⑦⑧⑨ | ④ | ③⑤⑥⑨ |
(3)⑨在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-.
(4)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)②与⑧发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的还原剂与氧化剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6mol.
| A. | 容器内压强不随时间变化 | B. | A、B、C、D四者共存 | ||
| C. | 消耗A的速率与生成A的速率相等 | D. | D、C的生成速率相等 |
| A. | 淀粉水解的最终产物为酒精 | B. | 纤维素水解的最终产物为麦芽糖 | ||
| C. | 油脂水解的产物之一为甘油 | D. | 蛋白质与浓硫酸作用呈黄色 |
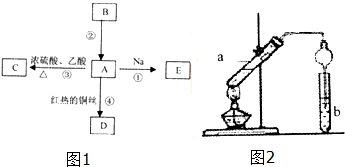 A是化学实验室中常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图1所示:
A是化学实验室中常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图1所示: