题目内容
19.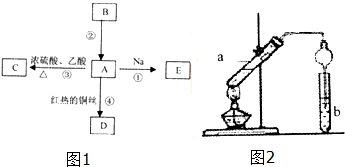 A是化学实验室中常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图1所示:
A是化学实验室中常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图1所示:(1)写出B的结构简式CH2=CH2;
(2)写出下列反应的化学方程式
反应①:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
反应④:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O
(3)实验室利用反应③制取C,常用如图2装置:
①a试管中的主要化学反应的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O反应类型是酯化反应.
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是防止液体倒吸.
③若要把制得的乙酸乙酯分离出来,应采用的实验操作是分液.
④生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态.下列描述不能说明该反应已达到化学平衡状态的是(填序号)AC.
A.单位时间里,生成lmol乙酸乙酯,同时生成lmol水
B.单位时间里,生成lmol乙酸乙酯,同时生成lmol乙酸
C.单位时间里,消耗lmol乙醇,同时消耗lmol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的浓度不再变化.
分析 B的产量可衡量一个国家石油化工发展的水平,B是乙烯,A是化学实验室中常见的有机物,它易溶于水并有特殊香味,根据框图中信息,A能与Na、乙酸反应,在红热铜丝发生催化氧化,可推知A是乙醇,根据框图中的转化关系、反应条件和反应试剂可推得,C是乙酸乙酯,D是乙醛,E是乙醇钠,生成乙酸乙酯的反应是可逆反应,根据平衡状态的特征判断反应是否处于平衡状态,据此解答.
解答 解:B的产量可衡量一个国家石油化工发展的水平,B是乙烯,A是化学实验室中常见的有机物,它易溶于水并有特殊香味,根据框图中信息,A能与Na、乙酸反应,在红热铜丝发生催化氧化,可推知A是乙醇,根据框图中的转化关系、反应条件和反应试剂可推得,C是乙酸乙酯,D是乙醛,E是乙醇钠,
(1)B是乙烯,结构简式为CH2=CH2,
故答案为:CH2=CH2;
(2)反应①是乙醇与钠反应生成乙醇钠与氢气,反应方程式为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,
反应④是乙醇在铜作催化剂、加热条件下催化氧化生成乙醛,反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(3)①a试管中的主要化学反应是乙酸与乙醇反应生成乙酸乙酯,化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,属于酯化反应,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;酯化反应;
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是防止液体倒吸,
故答案为:防止液体倒吸;
③乙酸乙酯是液体,与水不互溶,所以若要把制得的乙酸乙酯分离出来,应采用的实验操作是分液,
故答案为:分液;
④生成乙酸乙酯的反应是可逆反应,
A.单位时间里,生成lmol乙酸乙酯,同时生成lmol水,都是指正反应速率,不能说明正逆反应速率相等,故不能说明反应处于平衡状态;
B.单位时间里,生成lmol乙酸乙酯,同时生成lmol乙酸,说明正逆反应速率相等,故反应已处于平衡状态;
C.单位时间里,消耗lmol乙醇,同时消耗lmol乙酸,都是指正反应速率,不能说明正逆反应速率相等,故不能说明反应处于平衡状态
D.正反应的速率与逆反应的速率相等,根据平衡状态的定义可知,反应处于平衡状态;
E.混合物中各物质的浓度不再变化,根据平衡状态的定义可知,反应处于平衡状态,
故选AC.
点评 考查有机推断、乙酸乙酯的制取,涉及烯、醇、羧酸的性质与转化等,难度不大,是对常见有机物知识的简单运用,注意掌握各类有机物的性质.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案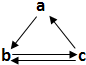 下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )| 选项 | a | b | c |
| A | S | SO3 | H2SO4 |
| B | Fe | FeCl2 | FeCl3 |
| C | HNO3 | NO | NO2 |
| D | CH2=CH2 | C2H5Br | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
| 海水密度(g/ml) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.022 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
(2)为了得到含较少杂质的粗盐,实际生产中卤水的密度控制在1.21-1.26范围之内.
(3)由上表可知先析出的物质是CaSO4.
(4)粗盐中常含有MgCl2、MgSO4和CaSO4等杂质,在实验室中依次加入abcd或bacd(填“序号”)等试剂,能将上述杂质除去.
a.BaCl2 b.NaOH c.Na2CO3 d.HCl.
| A. | 冬天气温低,反应速率降低,对环境污染会更大 | |
| B. | 改变压强对反应速率没有影响 | |
| C. | 使用催化剂能促使反应正向进行 | |
| D. | 无论外界条件怎样改变,均对此化学反应的速率无影响 |
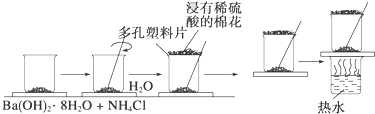
在一个小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据实验步骤,填写下表,并回答问题.
| 实验步骤 | 实验现象及结论 |
| 将晶体混合,立即快速搅拌 | 有刺激性气味能使湿润的紫色石蕊试纸变蓝的 ①产生 |
| 用手摸烧杯下部 | 感觉烧杯变凉说明此反应是 ②反应 |
| 用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上 | 玻璃片脱离上面烧杯底部 |
| 反应后移走多孔塑料片观察反应物 | 混合物成糊状,证明有 ③生成 |
④写出实验过程中发生反应的化学方程式:BaCl2•8H2O+2NH4Cl═BaCl2+2NH3•H2O+8H2O.
⑤实验中要立即用玻璃棒迅速搅拌的原因是:使反应物迅速混合而充分反应,使温度迅速下降.
⑥在上述实验过程中,为什么用浸有稀硫酸的湿棉花置于多孔塑料板上?反应过程中产生对人体有害的气体,会对环境造成污染,故应用浸有稀H2SO4的棉花覆盖在多孔塑料片上来吸收产生的NH3.
| A. | 羟甲基(-CH2OH)和甲氧基(CH3O-) | B. | S2-和Cl- | ||
| C. | Mg2+和F- | D. | 羟基(-OH)和氢氧根(OH-) |
①陶瓷②塑料③水泥④合成橡胶⑤合成纤维⑥玻璃.
| A. | ①②③ | B. | ①③⑥ | C. | ②④⑤ | D. | ③⑤⑥ |
| A. | 奥运火炬燃烧主要是将化学能转变为热能和光能 | |
| B. | 丙烷的沸点比正丁烷高 | |
| C. | 丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的负极 | |
| D. | 丙烷与甲烷属同系物,也无同分异构体 |
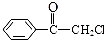 苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图所示,则苯氯乙酮不可能具有的化学性质是ce(填字母序号).
苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图所示,则苯氯乙酮不可能具有的化学性质是ce(填字母序号).