题目内容
2.可逆反应A(g)+B(g)?C(g)+D(g).在一定条件下,说明该反应已达到平衡状态的是( )| A. | 容器内压强不随时间变化 | B. | A、B、C、D四者共存 | ||
| C. | 消耗A的速率与生成A的速率相等 | D. | D、C的生成速率相等 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、反应前后,两边气体计量数相等,容器内压强始终不随时间变化而变化,故A错误;
B、只要反应发生就是反应物和生成物共存的体系,故B错误;
C、消耗A的速率与生成A的速率相等,说明正逆反应速率相等,故C正确;
D、只要反应发生就有D、C的生成速率相等,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
10.海水中含有丰富的化学资源.食盐是海水中的重要资源,海水在浓缩过程中析出盐的种类和质量如表(单位g/L):
(1)现代产盐常用盐田法(或太阳能蒸发法)方法从海水中得到食盐.
(2)为了得到含较少杂质的粗盐,实际生产中卤水的密度控制在1.21-1.26范围之内.
(3)由上表可知先析出的物质是CaSO4.
(4)粗盐中常含有MgCl2、MgSO4和CaSO4等杂质,在实验室中依次加入abcd或bacd(填“序号”)等试剂,能将上述杂质除去.
a.BaCl2 b.NaOH c.Na2CO3 d.HCl.
| 海水密度(g/ml) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.022 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
(2)为了得到含较少杂质的粗盐,实际生产中卤水的密度控制在1.21-1.26范围之内.
(3)由上表可知先析出的物质是CaSO4.
(4)粗盐中常含有MgCl2、MgSO4和CaSO4等杂质,在实验室中依次加入abcd或bacd(填“序号”)等试剂,能将上述杂质除去.
a.BaCl2 b.NaOH c.Na2CO3 d.HCl.
17.日常生活中会接触到许多化学物质,如牙膏、洁厕灵、“84”消毒液、漂白粉等等.
(1)如表列出了三种牙膏中的摩擦剂.请在表中填写三种摩擦剂所属的物质类别(指酸、碱、盐、氧化物)
(2)含氟牙膏活性成分为氟化钠,画出氟元素原子形成的阴离子结构示意图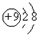 ,请写出氟化钠在水溶液中的电离方程式NaF=Na++F-.
,请写出氟化钠在水溶液中的电离方程式NaF=Na++F-.
(3)“84”消毒液的主要成分是次氯酸钠(NaClO),洁厕灵的主要成分是盐酸(HCl).据网络报道:“84”消毒液+洁厕灵→夺命毒气+水+氯化钠,因此在使用时应避免将两种物质混合.试写出“84”消毒液和洁厕灵混合时产生夺命毒气的化学方程式:NaClO+2HCl=NaCl+Cl2↑+H2O.
(4)使用漂白粉溶液除去白色衣物上的色斑,往往需要将衣物浸泡在其中且露置在空气中30分钟,再进行洗涤效果更好,用化学方程式表示其使用原理Ca(ClO)2+CO2+H2O=CaCO3+2HClO.
(1)如表列出了三种牙膏中的摩擦剂.请在表中填写三种摩擦剂所属的物质类别(指酸、碱、盐、氧化物)
| 儿童牙膏 | 防臭牙膏 | 透明牙膏 | |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 氧化硅 |
| 物质类别 | 碱 | 盐 | 氧化物 |
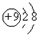 ,请写出氟化钠在水溶液中的电离方程式NaF=Na++F-.
,请写出氟化钠在水溶液中的电离方程式NaF=Na++F-.(3)“84”消毒液的主要成分是次氯酸钠(NaClO),洁厕灵的主要成分是盐酸(HCl).据网络报道:“84”消毒液+洁厕灵→夺命毒气+水+氯化钠,因此在使用时应避免将两种物质混合.试写出“84”消毒液和洁厕灵混合时产生夺命毒气的化学方程式:NaClO+2HCl=NaCl+Cl2↑+H2O.
(4)使用漂白粉溶液除去白色衣物上的色斑,往往需要将衣物浸泡在其中且露置在空气中30分钟,再进行洗涤效果更好,用化学方程式表示其使用原理Ca(ClO)2+CO2+H2O=CaCO3+2HClO.
7.NO和CO都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化2NO+2CO=N2+2CO2对此反应,下列叙述正确的是( )
| A. | 冬天气温低,反应速率降低,对环境污染会更大 | |
| B. | 改变压强对反应速率没有影响 | |
| C. | 使用催化剂能促使反应正向进行 | |
| D. | 无论外界条件怎样改变,均对此化学反应的速率无影响 |
14.某研究性学习小组在研究化学反应中的能量变化时,做了下面的实验:
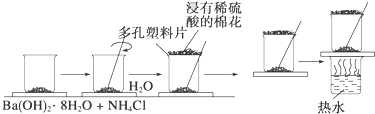
在一个小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据实验步骤,填写下表,并回答问题.
①NH3②吸热③水
④写出实验过程中发生反应的化学方程式:BaCl2•8H2O+2NH4Cl═BaCl2+2NH3•H2O+8H2O.
⑤实验中要立即用玻璃棒迅速搅拌的原因是:使反应物迅速混合而充分反应,使温度迅速下降.
⑥在上述实验过程中,为什么用浸有稀硫酸的湿棉花置于多孔塑料板上?反应过程中产生对人体有害的气体,会对环境造成污染,故应用浸有稀H2SO4的棉花覆盖在多孔塑料片上来吸收产生的NH3.

在一个小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据实验步骤,填写下表,并回答问题.
| 实验步骤 | 实验现象及结论 |
| 将晶体混合,立即快速搅拌 | 有刺激性气味能使湿润的紫色石蕊试纸变蓝的 ①产生 |
| 用手摸烧杯下部 | 感觉烧杯变凉说明此反应是 ②反应 |
| 用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上 | 玻璃片脱离上面烧杯底部 |
| 反应后移走多孔塑料片观察反应物 | 混合物成糊状,证明有 ③生成 |
④写出实验过程中发生反应的化学方程式:BaCl2•8H2O+2NH4Cl═BaCl2+2NH3•H2O+8H2O.
⑤实验中要立即用玻璃棒迅速搅拌的原因是:使反应物迅速混合而充分反应,使温度迅速下降.
⑥在上述实验过程中,为什么用浸有稀硫酸的湿棉花置于多孔塑料板上?反应过程中产生对人体有害的气体,会对环境造成污染,故应用浸有稀H2SO4的棉花覆盖在多孔塑料片上来吸收产生的NH3.
11.下列各项中两种粒子或基团所含电子数不相等的是( )
| A. | 羟甲基(-CH2OH)和甲氧基(CH3O-) | B. | S2-和Cl- | ||
| C. | Mg2+和F- | D. | 羟基(-OH)和氢氧根(OH-) |
12.分析图中的信息,下列说法正确的是( )


| A. | 分子发生化学变化时,会生成新的分子,但不会分裂成原子 | |
| B. | 2molH2和1molO2完全反应,结果放出930kJ的热量 | |
| C. | 1molH-H和$\frac{1}{2}$molO-O键的断裂过程共放出930KJ的热量 | |
| D. | 分析变化的全过程,可得出形成H-O键将放出能量 |
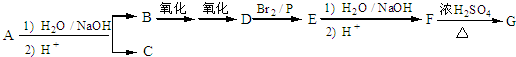
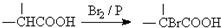
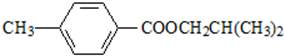 .
. ,该反应属于取代反应(或酯化反应) (填反应类型).
,该反应属于取代反应(或酯化反应) (填反应类型).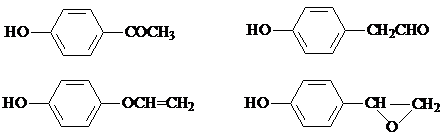 .
.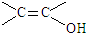 )结构.
)结构.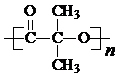 .
. 按要求书写:
按要求书写: ;-CH3
;-CH3

 系统命名法的名称3,3-二甲基-5-乙基庚烷
系统命名法的名称3,3-二甲基-5-乙基庚烷