题目内容
15.现有下列九种物质:①H2 ②铝 ③Na2O ④CO2⑤H2SO4 ⑥Ba(OH)2固体 ⑦氨水⑧稀硝酸⑨熔融Al2(SO4)3(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 | ②⑦⑧⑨ | ④ | ③⑤⑥⑨ |
(3)⑨在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-.
(4)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)②与⑧发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的还原剂与氧化剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6mol.
分析 (1)物质导电的条件是存在自由电子或者自由移动的离子;
电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;
非电解质是指:在水溶液里和熔融状态下都不导电的化合物;单质、混合物既不是电解质也不是非电解质;
(2)强酸与强碱反应生成可溶性盐和水的离子反应为H++OH-═H2O;
(3)Al2(SO4)3为强电解质,完全电离;
(4)二氧化碳少量,氢氧化钡溶液与二氧化碳反应生成碳酸钡沉淀和水,据此写出反应的离子方程式;
(5)Al+HNO3→Al(NO3)3+NO↑+H2O中,Al元素的化合价由0升高为+3价,N元素的化合价由+5价降低为+2价,结合电子守恒及原子守恒配平及计算.
解答 解:(1)②铝中含有自由电子,⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3都存在自由移动的离子,所以能够导电;
③CuO ⑤H2SO4 ⑥Ba(OH)2固体⑨熔融Al2(SO4)3都是化合物,在水溶液或者熔融状态下能够导电,属于电解质;
④CO2自身不能电离出自由移动离子,不能导电属于非电解质;
故答案为:②⑦⑧⑨;④;③⑤⑥⑨;
(2)强酸与强碱反应生成可溶性盐和水的离子反应为H++OH-═H2O,符合条件的化学反应为2HNO3+Ba(OH)2=Ba(NO3)2+2H2O,故答案为:2HNO3+Ba(OH)2=Ba(NO3)2+2H2O;
(3)Al2(SO4)3为强电解质,完全电离,电离方程式为Al2(SO4)3=2Al3++3SO42-,故答案为:Al2(SO4)3=2Al3++3SO42-;
(4)少量的④二氧化碳通入⑥氢氧化钡溶液中,反应生成碳酸钡沉淀和水,反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O,故答案为:Ba2++2OH-+CO2=BaCO3↓+H2O;
(5)Al+HNO3→Al(NO3)3+NO↑+H2O中,Al元素的化合价由0升高为+3价,N元素的化合价由+5价降低为+2价,由电子守恒及原子守恒可知,该反应为Al+4HNO3=Al(NO3)3+NO↑+2H2O,氧化剂为硝酸、还原剂为Al,二者的物质的量之比为1:1;5.4g Al发生反应时,转移电子的物质的量为$\frac{5.4g}{27g/mol}$×(3-0)=0.6mol,故答案为:1:1;0.6mol.
点评 本题考查铝的化学性质,为高频考点,涉及酸碱中和离子反应、电离、物质的量有关计算、氧化还原反应及计算等,把握化学用语的使用为解答的关键,综合性较强,注重高考高频考点的考查,题目难度不大.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系 能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
| A. | Q1=Q2=Q3 | |
| B. | 达到平衡时,丙容器中SO2的体积分数最大 | |
| C. | 甲、乙、丙3个容器中反应的平衡常数不相等 | |
| D. | 若在上述条件下反应生成2molSO3(s)的放热大于197kJ |
| 海水密度(g/ml) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.022 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
(2)为了得到含较少杂质的粗盐,实际生产中卤水的密度控制在1.21-1.26范围之内.
(3)由上表可知先析出的物质是CaSO4.
(4)粗盐中常含有MgCl2、MgSO4和CaSO4等杂质,在实验室中依次加入abcd或bacd(填“序号”)等试剂,能将上述杂质除去.
a.BaCl2 b.NaOH c.Na2CO3 d.HCl.
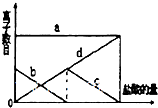 向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化.四条曲线与溶液中离子的对应关系,正确的是( )
向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化.四条曲线与溶液中离子的对应关系,正确的是( )| A. | a:Cl- b:K+ c:$C{{O}_{3}}^{2-}$ d:$HC{{O}_{3}}^{-}$ | |
| B. | a:Cl- b:$C{{O}_{3}}^{2-}$ c:K+ d:$HC{{O}_{3}}^{-}$ | |
| C. | a:K+ b:$C{{O}_{3}}^{2-}$ c:$HC{{O}_{3}}^{-}$ d:Cl- | |
| D. | a:K+ b:$HC{{O}_{3}}^{-}$ c:Cl- d:$C{{O}_{3}}^{2-}$ |
| A. | 冬天气温低,反应速率降低,对环境污染会更大 | |
| B. | 改变压强对反应速率没有影响 | |
| C. | 使用催化剂能促使反应正向进行 | |
| D. | 无论外界条件怎样改变,均对此化学反应的速率无影响 |
| A. | CCl4可由CH4制得,可用于萃取碘水中的碘 | |
| B. | 乙醇、乙酸和乙酸乙酯能用饱和碳酸钠溶液鉴别 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 蒸馏装置中,温度计的水银球应插入到混合溶液中 |

 Ⅱ.RCOOH$\stackrel{LiAlO_{4}}{→}$RCH2OH
Ⅱ.RCOOH$\stackrel{LiAlO_{4}}{→}$RCH2OH 、
、 .
. 、
、 .
.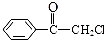 苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图所示,则苯氯乙酮不可能具有的化学性质是ce(填字母序号).
苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图所示,则苯氯乙酮不可能具有的化学性质是ce(填字母序号).