题目内容
18.2KMnO4═K2MnO4+MnO2+O2↑正确.分析 化学方程式的配平方法很多,可利用观察法、最小公倍数法、待定系数法等来配平,但应遵循质量守恒定律,利用原子在化学反应前后数目不变来配平.
解答 解:KMnO4-K2MnO4+MnO2+O2↑,因反应物只有一种,K的原子个数不同,可利用K原子来配平,则2KMnO4-K2MnO4+MnO2+O2↑,再分析Mn和O的原子个数,发现都相等,
即:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,
故答案为:正确.
点评 本题考查化学方程式配平正误,化学方程式配平的方法不是固定的,应根据具体的反应而定,总之,利用原子守恒来配平时怎么配平简单就怎么做,该题比较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.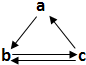 下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
 下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )| 选项 | a | b | c |
| A | S | SO3 | H2SO4 |
| B | Fe | FeCl2 | FeCl3 |
| C | HNO3 | NO | NO2 |
| D | CH2=CH2 | C2H5Br | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
6.相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.实验测得起始、平衡时的有关数据如表:
下列叙述正确的是( )
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系 能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
| A. | Q1=Q2=Q3 | |
| B. | 达到平衡时,丙容器中SO2的体积分数最大 | |
| C. | 甲、乙、丙3个容器中反应的平衡常数不相等 | |
| D. | 若在上述条件下反应生成2molSO3(s)的放热大于197kJ |
10.海水中含有丰富的化学资源.食盐是海水中的重要资源,海水在浓缩过程中析出盐的种类和质量如表(单位g/L):
(1)现代产盐常用盐田法(或太阳能蒸发法)方法从海水中得到食盐.
(2)为了得到含较少杂质的粗盐,实际生产中卤水的密度控制在1.21-1.26范围之内.
(3)由上表可知先析出的物质是CaSO4.
(4)粗盐中常含有MgCl2、MgSO4和CaSO4等杂质,在实验室中依次加入abcd或bacd(填“序号”)等试剂,能将上述杂质除去.
a.BaCl2 b.NaOH c.Na2CO3 d.HCl.
| 海水密度(g/ml) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.022 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
(2)为了得到含较少杂质的粗盐,实际生产中卤水的密度控制在1.21-1.26范围之内.
(3)由上表可知先析出的物质是CaSO4.
(4)粗盐中常含有MgCl2、MgSO4和CaSO4等杂质,在实验室中依次加入abcd或bacd(填“序号”)等试剂,能将上述杂质除去.
a.BaCl2 b.NaOH c.Na2CO3 d.HCl.
7.NO和CO都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化2NO+2CO=N2+2CO2对此反应,下列叙述正确的是( )
| A. | 冬天气温低,反应速率降低,对环境污染会更大 | |
| B. | 改变压强对反应速率没有影响 | |
| C. | 使用催化剂能促使反应正向进行 | |
| D. | 无论外界条件怎样改变,均对此化学反应的速率无影响 |
8.以石油化工为基础的三大合成材料是( )
①陶瓷②塑料③水泥④合成橡胶⑤合成纤维⑥玻璃.
①陶瓷②塑料③水泥④合成橡胶⑤合成纤维⑥玻璃.
| A. | ①②③ | B. | ①③⑥ | C. | ②④⑤ | D. | ③⑤⑥ |
 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
 .由A生成C的反应类型为消去反应.
.由A生成C的反应类型为消去反应. .
. 按要求书写:
按要求书写: ;-CH3
;-CH3

 系统命名法的名称3,3-二甲基-5-乙基庚烷
系统命名法的名称3,3-二甲基-5-乙基庚烷