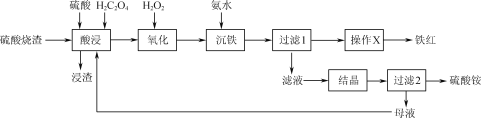
题目内容
【题目】H2O2既可以作氧化剂,又可以作还原剂。现在H2O2溶液中加入用硫酸酸化的KMnO4溶液,紫红色的KMnO4溶液变成了无色溶液。该反应体系中共七种物质:O2、KMnO4、MnSO4、H2SO4、K2SO4、H2O、H2O2。
(1)请将以上反应物与生成物分别填入以下空格内___。
![]()
(2)该反应中的还原剂是__(填化学式)被还原的元素是____(填元素符号)。
(3)如反应中电子转移了0.5mol,则产生的气体在标准状况下的体积为__L。
(4)+6价铬的化合物毒性较大,酸性溶液中常用NaHSO3将废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为___。
【答案】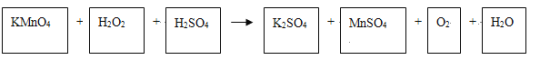 H2O2 Mn 5.6L 3HSO3-+ Cr2O72- +5H+= 2Cr3++3SO42-+4H2O
H2O2 Mn 5.6L 3HSO3-+ Cr2O72- +5H+= 2Cr3++3SO42-+4H2O
【解析】
H2O2溶液中加入用硫酸酸化的KMnO4溶液,紫红色的MnO4-被还原成了无色Mn2+,则反应中H2O2应被氧化,生成氧气和水,结合氧化剂和还原剂之间得失电子数目相等配平化学方程式,则反应物和生成物的转化关系为2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O;反应中MnO4-被还原,Mn元素化合价降低,H2O2被氧化,H2O2为还原剂;根据转移的电子的物质的量与生成物氧气之间的关系计算产生的气体在标准状况下的体积;根据元素守恒,电荷守恒,写出化学方程式,并且配平。
(1)H2O2溶液中加入用硫酸酸化的KMnO4溶液,紫红色的MnO4-被还原成了无色Mn2+,则反应中H2O2的化合价升高,应被氧化,生成氧气和水,KMnO4+H2O2+H2SO4→K2SO4+MnSO4+O2↑+H2O 结合氧化剂和还原剂之间得失电子数目相等配平化学方程式,则反应物和生成物的转化关系为2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O;
(2)反应中MnO4-中的Mn元素化合价降低,是被还原的元素,H2O2被氧化,H2O2为还原剂;
(3)根据反应方程式2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O可知,Mn元素化合价从+7降低到+2价,有2个锰原子化合价降低,2molKMnO4参加反应共转移了10mol电子,过氧化氢中氧原子的化合价从-1价升高到0价,剩余的四个氧原子从-2价升高到0价,共转移10mol电子,产生气体的物质的量为5mol,则反应中电子转移了0.5mol,则产生的气体的物质的量为0.25mol,在标准状况下的体积为0.25mol ×22.4L/mol=5.6L;
(4)+6价铬的化合物毒性较大,酸性溶液中常用NaHSO3将废液中的Cr2O72-还原成Cr3+,氧化还原反应中有元素的化合价升高,就有元素的化合价降低,Cr元素化合价由+6价降低为+3价,则NaHSO3中S元素的化合价应该有+4价升高为+6价,根据元素守恒,电荷守恒,该反应的离子方程式为3HSO3-+ Cr2O72- +5H+=2Cr3++3SO42-+4H2O。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】下列各组中离子在水溶液中能大量共存且满足相应要求的是( )
选项 | 离子 | 要求 |
A | K+、NO | c(K+)<c(Cl-) |
B | Na+、NO | 逐滴滴加盐酸立即有气体产生 |
C | Na+、Al3+、Mg2+、SO | 逐滴滴加氨水立即有沉淀产生 |
D | NH | 滴加NaOH浓溶液立刻有气体产生 |
A.AB.BC.CD.D