题目内容
【题目】某课外小组同学设计如图实验装置(部分夹持仪器未画出)探究氨气的还原性并检验部分产物。
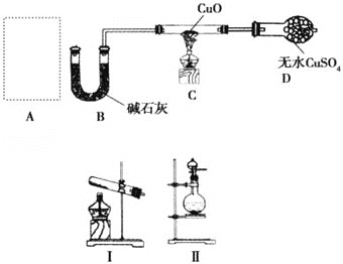
(1)若A中使用装置Ⅰ制取氨气,则化学方程式为__,发生装置试管口略向下倾斜的原因_____;若A中使用装置Ⅱ制取氨气,则分液漏斗中的试剂为__,圆底烧瓶中的固体可以为__。
(2)B中碱石灰的作用是__。
(3)氨气还原炽热氧化铜的化学方程式为__,装置C中的实验现象为__,装置D中的实验现象为__。
(4)①该装置存在明显的缺陷是__。
②请画出改进后需要增加连接的实验装置图________。
【答案】 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 防止水倒流使试管炸裂 浓氨水 NaOH(或CaO或碱石灰) 吸收氨气中的水蒸气 3CuO+2NH3
CaCl2+2NH3↑+2H2O 防止水倒流使试管炸裂 浓氨水 NaOH(或CaO或碱石灰) 吸收氨气中的水蒸气 3CuO+2NH3![]() 3Cu+N2+3H2O 黑色CuO变为红色 白色无水CuSO4粉末变蓝 没有尾气吸收装置,NH3排入大气,污染环境
3Cu+N2+3H2O 黑色CuO变为红色 白色无水CuSO4粉末变蓝 没有尾气吸收装置,NH3排入大气,污染环境 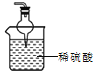
【解析】(1)装置I适用于固体+固体![]() 气体,使用装置I制NH3的反应原理为2NH4Cl+Ca(OH)2
气体,使用装置I制NH3的反应原理为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。装置II适用于固体+液体→气体,使用装置II制NH3可用浓氨水与NaOH(或CaO或碱石灰)。
CaCl2+2NH3↑+2H2O。装置II适用于固体+液体→气体,使用装置II制NH3可用浓氨水与NaOH(或CaO或碱石灰)。
(2)B中碱石灰的作用是:吸收氨气中的水蒸气。
(3)氨气与炽热的CuO反应生成N2、Cu和H2O。
(4)①NH3污染大气,该装置的明显缺陷是:没有尾气吸收装置。
②改进方法是:在装置末端增加尾气吸收装置,用稀硫酸吸收NH3并防倒吸。
(1)装置I适用于固体+固体![]() 气体,使用装置I制NH3的反应原理为2NH4Cl+Ca(OH)2
气体,使用装置I制NH3的反应原理为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,发生装置试管口略向下倾斜的原因是:防止水倒流使试管炸裂。装置II适用于固体+液体→气体,使用装置II制NH3可用浓氨水与NaOH(或CaO或碱石灰),分液漏斗中的试剂为浓氨水,圆底烧瓶中的固体可以为NaOH(或CaO或碱石灰)。
CaCl2+2NH3↑+2H2O,发生装置试管口略向下倾斜的原因是:防止水倒流使试管炸裂。装置II适用于固体+液体→气体,使用装置II制NH3可用浓氨水与NaOH(或CaO或碱石灰),分液漏斗中的试剂为浓氨水,圆底烧瓶中的固体可以为NaOH(或CaO或碱石灰)。
(2)实验室制得的NH3中都混有H2O(g),B中碱石灰的作用是:吸收氨气中的水蒸气,防止干扰CuO与NH3反应的生成物H2O的检验。
(3)氨气与炽热的CuO反应生成N2、Cu和H2O,反应的化学方程式为3CuO+2NH3![]() 3Cu+N2+3H2O。装置C中的实验现象为:黑色CuO变为红色。由于有H2O生成,装置D中的实验现象为:白色无水CuSO4粉末变蓝。
3Cu+N2+3H2O。装置C中的实验现象为:黑色CuO变为红色。由于有H2O生成,装置D中的实验现象为:白色无水CuSO4粉末变蓝。
(4)①NH3污染大气,该装置的明显缺陷是:没有尾气吸收装置,NH3排入大气,污染环境。
②改进方法是:在装置末端增加尾气吸收装置,用稀硫酸吸收NH3并防倒吸,连接的实验装置图为 。
。