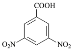
题目内容
【题目】I.已知:① NaHCO3(s)==Na+(ag)+HCO3-(aq) △H=+18.81kJ·mo1-1
②Na2CO3(s)==2Na+(aq)+CO32-(aq)△H=-16.44 k J· mol-1
③2NaHCO3(s)==Na2CO3(s)+CO2(g)+H2O(1) △H=+92.34kJ·mol-1
请回答:
(1)资料显示,NaHCO3固体加热到100℃发生分解,但是加热 NaHCO3溶液不到80℃就有大量CO2气体放出,用反应热角度说明原因_________________________________。
(2) NaHCO3溶液中主要存在2种化学平衡:a.HCO3-+H2O![]() H2CO3+OH-,b.2HCO3-
H2CO3+OH-,b.2HCO3-![]() CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图所示(不考虑相互影响):
CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图所示(不考虑相互影响):

①计算25℃0.10mol·L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为___________mol·L-1。
②加热蒸干NaHCO3溶液最后得到的固体是___________。
③25℃时0.10mol·L-1的NaHCO3溶液pH=8.3,加热到4分钟溶液沸腾,后保温到7分钟。已知常温下Na2CO3溶液浓度和pH的关系如下表(忽略温度对Kw的影响):
c(mo1·L-1) | 饱和 | 0.20 | 0.10 | 0.010 | 0.0010 |
pH | 12.1 | 11.8 | 11.5 | 11.1 | 10.6 |
请在图中作出 NaHCO3溶液pH随时间变化曲线______________

II.研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图

(1)T℃时,向1L恒容密闭容器中充入0.3 mol CH4,只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4
C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4
(2)列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
(3)由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有_________________________________。
【答案】2HCO3—(aq) == CO32—(aq)+CO2(g)+H2O(l) △H=+38.28kJmol—1,反应需要的能量比固体小 1.7×10—3 Na2CO3 
66.7 % 5 5.0×104 充入适量的乙烯
【解析】
根据图象信息判断化学平衡移动方向进而进一步推断和计算;根据气体分压计算平衡常数分析解答;根据三段式分析计算化学平衡中的各组分数据。
(1) 根据所给热化学方程式结合盖斯定律可得2HCO3—(aq) == CO32—(aq)+CO2(g)+H2O(l) △H=+38.28kJmol—1,所以加热 NaHCO3溶液需要的能量比固体小;
故答案为:2HCO3—(aq) == CO32—(aq)+CO2(g)+H2O(l) △H=+38.28kJmol—1,反应需要的能量比固体小;
(2) ①根据图象可知,25℃时,HCO3-的转化率为0.2%,即生成H2CO3的浓度为:0.10mol·L-1×0.2%=2×10-4mol/L,25℃时,反应b中HCO3—的转化率为3.0%,即生成CO2的浓度为:0.10mol·L-1×3.0%×![]() =1.5×10-3mol/L,所以25℃0.10mol·L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为:2×10-4mol/L+1.5×10-3mol/L=1.7×10—3mol/L;
=1.5×10-3mol/L,所以25℃0.10mol·L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为:2×10-4mol/L+1.5×10-3mol/L=1.7×10—3mol/L;
故答案为:1.7×10—3;
②加热蒸干NaHCO3溶液,NaHCO3受热分解生成Na2CO3、CO2、和水,所以最后得到的固体是Na2CO3;
故答案为:Na2CO3;
③根据已知条件,碳酸钠的起始pH应该为8.3,所以起点从8.3出发,由表格中碳酸钠的浓度是0.10mol/L时,pH为11.5,即4分钟时,碳酸钠溶液的pH为11.5,保温7分钟内,pH变化不大;
故答案为: ;
;
II.(1)根据方程式 2CH4(g)![]() C2H4(g)+2H2(g),假设达到平衡时,生成n(C2H4)为xmol,
C2H4(g)+2H2(g),假设达到平衡时,生成n(C2H4)为xmol,
起始(n) 0.3mol 0mol 0mol
反应 (n) 2xmol xmol 2xmol
平衡(n) (0.3-2x)mol xmol 2xmol,由于恒容密闭容器体积不变,所以达到平衡时,c(C2H4)=c(CH4),即n(C2H4)=n(CH4)=x=0.3-2x,计算得x=0.1mol,甲烷的转化率为:![]() =66.7%,从图象可知,温度升高,各气体的分压减小,即反应向逆反应方向移动,所以甲烷的物质的量增加,则T2>T,假设再次平衡时乙烯的物质的量是ymol,则根据方程式可知生成甲烷的物质的量是2ymol,因此0.1+2y=2×(0.1-y),解得y=0.025mol,这说明甲烷的物质的量增加了0. 1mol-0.025mol×2=0.05mol,所以时间t=
=66.7%,从图象可知,温度升高,各气体的分压减小,即反应向逆反应方向移动,所以甲烷的物质的量增加,则T2>T,假设再次平衡时乙烯的物质的量是ymol,则根据方程式可知生成甲烷的物质的量是2ymol,因此0.1+2y=2×(0.1-y),解得y=0.025mol,这说明甲烷的物质的量增加了0. 1mol-0.025mol×2=0.05mol,所以时间t=![]() =5s;
=5s;
故答案为:66.7%;5s;
(2)根据图象可知,平衡时甲烷、氢气、乙炔的平均分压分别是103、104、![]() ,所以
,所以
A点温度时的平衡常数为:K=![]() =5.0×104;
=5.0×104;
故答案为;5.0×104;
(3)根据方程式可知,增大乙烯的浓度可以增大甲烷的浓度,进而提高乙炔的转化率;
故答案为:充入适量的乙烯。