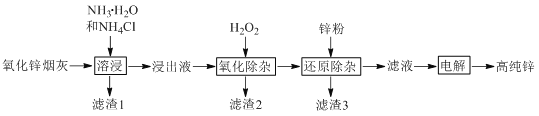
题目内容
【题目】化合物H(碘他拉酸)可用于CT检查、动静脉造影等,其一种合成路线如下:

(1)H中的含氧官能团名称为_____。
(2)F→G的反应类型为_____。
(3)E的分子式为C9H8N2O5,E→F发生还原反应,写出E的结构简式:_____。
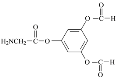
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_____。
①在酸性条件下能水解生成X、Y、Z三种有机物。
②X是一种氨基酸,Y能发生银镜反应,Z能与FeCl3溶液发生显色反应且分子中只有2种不同化学环境的氢。
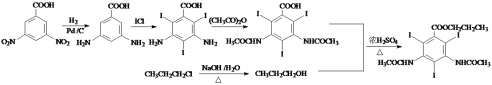
(5)泛影酸丙酯( )是一种医学诊断剂,写出以
)是一种医学诊断剂,写出以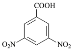 、CH3CH2CH2Cl和(CH3CO)2O为原料制备泛影酸丙酯的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _________________。
、CH3CH2CH2Cl和(CH3CO)2O为原料制备泛影酸丙酯的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _________________。
【答案】羧基和酰胺键 取代反应 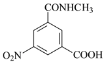
 或
或
【解析】
(1)根据H的结构简式,H中含氧官能团是酰胺键、羧基;
(2)对比F和G的结构简式,ICl中I取代苯环上的H,因此F→G的反应类型为取代反应;
(3)对比D和F的结构简式,D→F:-NHCH3取代D中-OCH3的位置,E→F发生还原反应,-NO2→-NH2,即E的结构简式为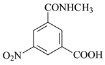 ;
;
(4)①该同分异构体能水解,说明含有酯基或酰胺基,②X是一种氨基酸,氨基酸中含有氨基和羧基,Y能发生银镜反应,则Y为可能含有醛基,也可能是甲酸,Z能与FeCl3发生显色反应,说明含有酚羟基,分子中只有2种不同化学环境的氢,说明是对称结构,根据C的结构简式,推出符合条件的结构简式为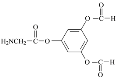 或
或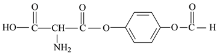 ;
;
(5)根据题中所给转化过程, 先于H2发生还原反应,生成
先于H2发生还原反应,生成 ,然后与ICl发生取代反应,生成
,然后与ICl发生取代反应,生成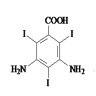 ,然后与乙酸酸酐发生反应,生成
,然后与乙酸酸酐发生反应,生成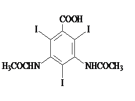 ,最后与丙醇发生酯化反应得到产物,丙醇由CH3CH2CH2Cl发生水解得到,合成泛影酸丙酯的流程为
,最后与丙醇发生酯化反应得到产物,丙醇由CH3CH2CH2Cl发生水解得到,合成泛影酸丙酯的流程为 ;
;

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案【题目】I.已知:① NaHCO3(s)==Na+(ag)+HCO3-(aq) △H=+18.81kJ·mo1-1
②Na2CO3(s)==2Na+(aq)+CO32-(aq)△H=-16.44 k J· mol-1
③2NaHCO3(s)==Na2CO3(s)+CO2(g)+H2O(1) △H=+92.34kJ·mol-1
请回答:
(1)资料显示,NaHCO3固体加热到100℃发生分解,但是加热 NaHCO3溶液不到80℃就有大量CO2气体放出,用反应热角度说明原因_________________________________。
(2) NaHCO3溶液中主要存在2种化学平衡:a.HCO3-+H2O![]() H2CO3+OH-,b.2HCO3-
H2CO3+OH-,b.2HCO3-![]() CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图所示(不考虑相互影响):
CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图所示(不考虑相互影响):

①计算25℃0.10mol·L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为___________mol·L-1。
②加热蒸干NaHCO3溶液最后得到的固体是___________。
③25℃时0.10mol·L-1的NaHCO3溶液pH=8.3,加热到4分钟溶液沸腾,后保温到7分钟。已知常温下Na2CO3溶液浓度和pH的关系如下表(忽略温度对Kw的影响):
c(mo1·L-1) | 饱和 | 0.20 | 0.10 | 0.010 | 0.0010 |
pH | 12.1 | 11.8 | 11.5 | 11.1 | 10.6 |
请在图中作出 NaHCO3溶液pH随时间变化曲线______________

II.研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图

(1)T℃时,向1L恒容密闭容器中充入0.3 mol CH4,只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4
C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4
(2)列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
(3)由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有_________________________________。
【题目】在三个容积相同的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下发生反应CH4(g)+ H2O(g) ![]() CO(g) + 3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如图所示。
CO(g) + 3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如图所示。
容器 | 起始物质的量/mol | CH4的平衡 转化率 | |||
CH4 | H2O | CO | H2 | ||
Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
Ⅱ | 0.1 | 0.1 | 0.1 | 0.3 | / |
Ⅲ | 0 | 0.1 | 0.2 | 0.6 | / |
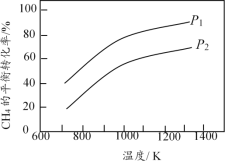
下列说法错误的是
A. 该反应的![]() H>0,图中压强P1>P2
H>0,图中压强P1>P2
B. 起始时,容器Ⅱ中v(CH4)正<v(CH4)逆
C. 达到平衡时,容器Ⅰ、Ⅱ中CO的物质的量满足:n(CO)Ⅱ< 2n(CO)Ⅰ
D. 达到平衡时,容器Ⅱ、Ⅲ中气体的总压强之比PⅡ∶PⅢ = 4∶5