题目内容
【题目】下列分子中各原子不在同一平面上的是( )
A.乙烷B.乙烯
C.二氧化碳D.苯
【答案】A
【解析】
A.乙烷中C均为四面体结构,则乙烷中所有原子不可能共面,故A选;
B.乙烯含碳碳双键,为平面结构,所有原子一定共面,故B不选;
C.二氧化碳的结构式为O=C=O,所有原子共面,故C不选;
D.苯为平面结构,所有原子共面,故D不选;
故选A。

【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g) +Y(g)![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法不正确的是( )
A. 反应前2min的平均速率v(Z)=4.0×10-3mol/(L·min)
B. 其他条件不变,升高温度,反应达到新平衡前v(正)<v(逆)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
【题目】制备纯净的液态无水四氯化锡的反应为Sn+2Cl2 ![]() SnCl4, Sn也可以与HC1反应生成SnCl2(SnCl4易挥发形成气体,极易发生水解,水解生成SnO2·xH20)。已知:
SnCl4, Sn也可以与HC1反应生成SnCl2(SnCl4易挥发形成气体,极易发生水解,水解生成SnO2·xH20)。已知:
物质 | 摩尔质量(g/mol) | 熔点(℃) | 沸点(℃) |
Sn | 119 | 231 | 2260 |
SnCl2 | 190 | 246 | 623 |
SnCl4 | 261 | -30 | 114 |
制备装置如图所示:
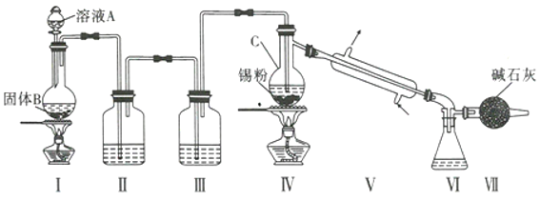
回答下列问题:
(1) Sn在元素周期表中的位罝为____________________________。
(2) Ⅱ、Ⅲ中的试剂分別为_______、__________;Ⅶ的作用是____________________、_____________。
(3)实验所得SnCl4因溶解了Cl2而略显黄色,提纯SnCl4的方法是____________(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.重结晶 d.蒸馏 e.过滤
(4)写出I中反应的化学方程式:_____________________________________。
(5)加热Sn粒之前要先让氯气充满整套装置,其目的是_________________。
(6)写出SnCl4水解的化学方程式:________________________________________。
【题目】I.已知:① NaHCO3(s)==Na+(ag)+HCO3-(aq) △H=+18.81kJ·mo1-1
②Na2CO3(s)==2Na+(aq)+CO32-(aq)△H=-16.44 k J· mol-1
③2NaHCO3(s)==Na2CO3(s)+CO2(g)+H2O(1) △H=+92.34kJ·mol-1
请回答:
(1)资料显示,NaHCO3固体加热到100℃发生分解,但是加热 NaHCO3溶液不到80℃就有大量CO2气体放出,用反应热角度说明原因_________________________________。
(2) NaHCO3溶液中主要存在2种化学平衡:a.HCO3-+H2O![]() H2CO3+OH-,b.2HCO3-
H2CO3+OH-,b.2HCO3-![]() CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图所示(不考虑相互影响):
CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图所示(不考虑相互影响):

①计算25℃0.10mol·L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为___________mol·L-1。
②加热蒸干NaHCO3溶液最后得到的固体是___________。
③25℃时0.10mol·L-1的NaHCO3溶液pH=8.3,加热到4分钟溶液沸腾,后保温到7分钟。已知常温下Na2CO3溶液浓度和pH的关系如下表(忽略温度对Kw的影响):
c(mo1·L-1) | 饱和 | 0.20 | 0.10 | 0.010 | 0.0010 |
pH | 12.1 | 11.8 | 11.5 | 11.1 | 10.6 |
请在图中作出 NaHCO3溶液pH随时间变化曲线______________

II.研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图

(1)T℃时,向1L恒容密闭容器中充入0.3 mol CH4,只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4
C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4
(2)列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
(3)由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有_________________________________。

