题目内容
8.下列离子方程式中,不正确的是( )| A. | Na2S溶液中通入适量H2S:S2-+H2S═2HS- | |
| B. | 氧化铁溶于氢碘酸:Fe2O3+6H-═2Fe3++3H2O | |
| C. | 过量铁粉加入稀HNO3溶液中:3Fe+8H++2NO${\;}_{3}^{-}$═3Fe2++2NO↑+4H2O | |
| D. | NaHSO3溶液显酸性的原因:HSO${\;}_{3}^{-}$+H2O?SO${\;}_{3}^{2-}$+H3O- |
分析 A.硫离子与硫化氢反应生成HS-;
B.铁离子与碘离子发生氧化还原反应;
C.铁粉过量,反应生成硝酸亚铁、NO气体和水;
D.亚硫酸氢根离子在溶液中部分电离出氢离子,溶液显示酸性.
解答 解:A.Na2S溶液中通入适量H2S,反应生成NaHS,反应的离子方程式为:S2-+H2S═2HS-,故A正确;
B.氧化铁溶于氢碘酸,二者发生氧化还原反应,正确的离子方程式为:Fe2O3+6H++2I-=2Fe2++I2+3H2O,故B错误;
C.过量铁粉加入稀HNO3溶液中,反应生成亚铁离子,反应的离子方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故C正确;
D.NaHSO3溶液中,亚硫酸氢根离子在溶液中部分电离出氢离子,溶液显示酸性,电离方程式为:HSO3-+H2O?SO32-+H3O+,故D正确;
故选B.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
18.下列离子方程式书写正确的是( )
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO${\;}_{3}^{-}$=CaCO3↓+2H2O+CO${\;}_{3}^{2-}$ | |
| C. | 铝和烧碱溶液:2Al+2OH-+2H2O=2AlO${\;}_{2}^{-}$+3H2↑ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-=AlO${\;}_{2}^{-}$+2H2O |
19.常温下在下列条件时,能大量共存的微粒组是( )
| 化学式 | 电离常熟(25) |
| CH3COOH | K1=1.7×10-5 |
| HClO | K1=3.0×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 如表提供的数据下:HClO、HCO3-、ClO-、CO32- | |
| B. | c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | pH=3的溶液中:CO32-、Na+、SO42-、AlO2- |
3.下列关于苯乙烯(结构简式为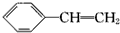 )可以发生的反应是( )
)可以发生的反应是( )
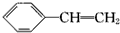 )可以发生的反应是( )
)可以发生的反应是( )| A. | 氧化反应 | B. | 加成反应 | ||
| C. | 能与酸性重铬酸钾反应 | D. | 加聚反应 | ||
| E. | 能使溴水褪色 |
13.0.1molNa2SO4溶解在多少mol水中,才能使每100个水分子中含有一个Na+离子( )
| A. | 5mol | B. | 10mol | C. | 20mol | D. | 30mol |
17.下列各组反应,前后均可以用同一个离子方程式表示的是( )
| A. | HCl+Na2CO3═HCl+NaHCO3 | B. | HCl+Na2CO3═H2SO4+K2CO3 | ||
| C. | H2S+NaOH═H2SO4+KOH | D. | BaCl2+Na2SO4═BaCO3+H2SO4 |
18.将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体.原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )
| A. | 231.5mL | B. | 268.8mL | C. | 282.5mL | D. | 313.6mL |
