题目内容
12.NA代表阿伏加德罗常数,下列叙述正确的是( )| A. | 1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子 | |
| B. | 1 mol O2在反应中得到电子数一定为4 NA | |
| C. | 1 mol Cl2在反应中得到电子数不一定为2NA | |
| D. | 在2KClO3+4HC1(浓)═2KCl+2C1O2↑+C12↑+2H2O中,氯气既是氧化产物又是还原产物,每生成1 mol Cl2转移2 NA 个电子 |
分析 A、过氧化钠与水的反应为歧化反应;
B、氧气在反应中可能变为-1价或-2价;
C、氯气可能发生自身的氧化还原反应;
D、根据在氧化还原反应中,化合价“只靠拢,不交错”来分析.
解答 解:A、过氧化钠与水的反应为歧化反应,1mol过氧化钠转移1mol电子即NA个,故A错误;
B、氧气在反应中可能变为-1价或-2价,故1mol氧气在反应中得到的电子数可能为2NA或4NA,故B错误;
C、由于氯气能发生歧化反应,故1mol氯气在反应中得到的电子数可能为2NA,但也可能为NA个,故C正确;
D、在氧化还原反应中,化合价“只靠拢,不交错”,故氯气是由HCl氧化得来,只是氧化产物,不是还原产物,C1O2是由KClO3还原得来,是还原产物;此反应转移2mol电子,生成1mol氯气,故当生成1mol氯气时转移2NA个电子,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,本题解答的关键是掌握常见元素的化合价.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
2.下列化合物只含有离子键的是( )
| A. | KCl | B. | Na2O2 | C. | KOH | D. | H2O |
3.化学反应A2+B2═2AB的能量变化如图所示,则下列说法不正确的是( )


| A. | 该反应是放热反应 | |
| B. | 断裂2 mol A-B 键需要吸收y kJ的能量 | |
| C. | 断裂1 mol A-A 键和1 mol B-B 键放出x kJ能量 | |
| D. | 1 mol A2和1 mol B2的总能量高于2 mol AB的总能量 |
20.在透明溶液中能大量共存的是( )
| A. | K+、Cu2+、Na+、Cl- | B. | H+、Na+、NO3-、HCO3- | ||
| C. | Ba2+、H+、NO3-、SO42- | D. | Mg2+、Na+、OH-、SO42- |
2.海洋中有丰富的食品、矿产、药物和水产等资源,下列有关说法正确的是( )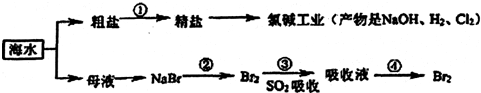

| A. | 海水淡化的主要方法有蒸馏法、电渗析法、离子交换法等 | |
| B. | 第①步中除去粗盐中可溶性杂质,可依次加入Na2CO3、Ba(OH)2、盐酸等试剂 | |
| C. | 在第②③④步中溴元素均被氧化 | |
| D. | 第④步涉及的分离操作有过滤、萃取、蒸馏 |
 如图装置,用电化学原理制备硫酸,并电解500mL 0.2mol?L-1AgNO3溶液.请回答下列问题:
如图装置,用电化学原理制备硫酸,并电解500mL 0.2mol?L-1AgNO3溶液.请回答下列问题:
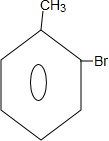 ;B→C的反应类型是取代反应.
;B→C的反应类型是取代反应.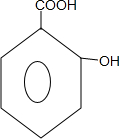 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$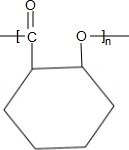 +nH2O.
+nH2O.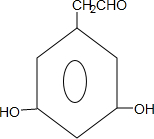 、
、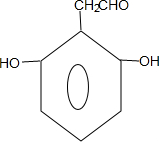 .
.