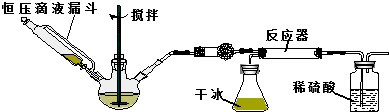
题目内容
13.已知 C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-110.5kJ/mol,2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ/mol,试写出固态碳和氧气反应生成二氧化碳的热化学反应方程式:分析 依据热化学方程式和盖斯定律计算得到,①-②÷$\frac{1}{2}$得到固态碳和氧气反应生成二氧化碳的热化学反应方程式.
解答 解:①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-110.5kJ/mol,
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ/mol,
依据盖斯定律计算,①-②÷$\frac{1}{2}$得到固态碳和氧气反应生成二氧化碳的热化学反应方程式为:C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,
故答案为:C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol.
点评 本题考查了热化学方程式书写方法,盖斯定律计算应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | 金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 | |
| B. | 碱灼伤先用大量水冲洗,后用稀盐酸或稀硫酸擦洗,再用水清洗 | |
| C. | 利用数字手持传感器技术可实时绘制中和滴定曲线 | |
| D. | 邻苯二甲酸氢钾可用于标定NaOH溶液的浓度,假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小 |
8.下列说法中正确的是( )
| A. | 标准状况下,11.2L N2和17g NH3中所含有的N原子数相同 | |
| B. | 9g H2O和0.5mol O2中含的原子数相同 | |
| C. | 20℃时,相同体积的N2、O2一定含有相同的分子数 | |
| D. | 在常温常压下,20mL CH4与60mL O2所含的原子个数比为1:3 |
18.一定量的质量分数为14%的KOH溶液,若将其蒸发掉100g水后,其质量分数为28%,体积为80mL,则浓缩后的KOH的物质的量浓度为( )
| A. | 2.2 mol•L-1 | B. | 4 mol•L-1 | C. | 5 mol•L-1 | D. | 6.25 mol•L-1 |
5.已知A(g)+C(g)=D(g);△H=-Q1kJ/mol,B(g)+C(g)=E(g),△H=-Q2kJ/mol,Q1、Q2均大于0,且Q1>Q2,若A与B组成的混合气体1mol与足量的C反应,放热为Q3kJ,则原混合气体中A与B物质的量之比为( )
| A. | $\frac{{Q}_{3}-{Q}_{2}}{{Q}_{1}-{Q}_{3}}$ | B. | $\frac{{Q}_{1}-{Q}_{3}}{{Q}_{3}-{Q}_{2}}$ | C. | $\frac{{Q}_{3}-{Q}_{2}}{{Q}_{1}-{Q}_{2}}$ | D. | $\frac{{Q}_{1}-{Q}_{3}}{{Q}_{1}-{Q}_{2}}$ |
2.下列化合物只含有离子键的是( )
| A. | KCl | B. | Na2O2 | C. | KOH | D. | H2O |
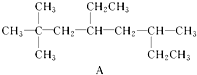
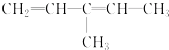 该烃系统命名为:3-甲基-1,3-戊二烯
该烃系统命名为:3-甲基-1,3-戊二烯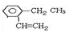 .
.