题目内容
14.1887年,英国人赫勒森(Wilhelm Hellesen)发明了最早的干电池,如今干电池已经发展成为一个庞大的家族,种类达100多种.应用广泛的是Zn-MnO2干电池,其电解质溶液是ZnCl2-NH4Cl混合溶液.电池工作一段时间后,电池内存在7 种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn 和H2O.回答下列问题:(1)该电池的负极材料是Zn;电池工作时,电子流向正极(填“正极”或“负极”);放电时NH4+向正极(填“正极”、“负极”)移动.
(2)完成并配平该氧化还原方程式:Zn+2MnO2+2 NH4Cl=Mn2O3+ZnCl2+H2O+2NH3;发生还原反应的物质是MnO2,被氧化的元素是Zn.若有17.4g 氧化剂参与反应,则电子转移数目为0.2NA(NA表示阿伏加德罗常数).
(3)普通锌一锰电池的缺点是电量小、放电电流弱.为增大放电电流,可把负极锌片改为锌粉,其理由是使反应面积增大,提高放电效率.
(4)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀.欲除去Cu2+,最好选用下列试剂中的b(填代号).
a.NaOH b.Zn c.Fe d.NH3•H2O
(5)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液.阴极的电极反应式是2H++2e-═H2↑.若电解电路中通过2mol电子,MnO2的理论产量为87g.
分析 (1)电池负极是活泼金属发生氧化反应,所以负极材料是锌,电子由电池的负极流向正极,放电时阴离子向负极移动,阳离子向正极移动;
(2)锌失去电子,生成锌离子,而二氧化锰得电子,变成三氧化二锰,根据得失电子守恒配平得:2MnO2+2NH4Cl+Zn=NH3+Mn2O3+ZnCl2+H2O,锌失电子发生氧化反应,被氧化,而二氧化锰中的锰由+4价变成+3价,发生还原反应,17.4gMnO2的物质的量=$\frac{17.4g}{87g/mol}$=0.2mol,而锰由+4价变成+3价,1mol转移1mol电子,则是0.2mol转移0.2mol的电子;
(3)锌片改为锌粉,固体表面积增大,反应速率增大;
(4)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀.除杂时不能引入新杂质,应选Zn将Cu2+ 置换为单质而除去;(5)电解酸化的MnSO4溶液时,根据离子的放电顺序,阴极上首先放电的是H+,电极反应式为:2H++2e-=H2↑,阳极反应式为:Mn2+-2e-+2H2O═MnO2++4H+,若电路中通过2mol电子产生1molMnO2,质量为87g.
解答 解:(1)电池负极是活泼金属发生氧化反应,所以负极材料是锌,电子由电池的负极,锌极流向正极,放电时阴离子向负极移动,阳离子向正极移动,
故答案为:Zn;正极;正极;
(2)锌失去电子,生成锌离子,而二氧化锰得电子,变成三氧化二锰,根据得失电子守恒配平得:2MnO2+2NH4Cl+Zn=NH3+Mn2O3+ZnCl2+H2O,二氧化锰中的锰由+4价变成+3价,发生还原反应,而锌失电子发生氧化反应,被氧化,17.4gMnO2的物质的量=$\frac{17.4g}{87g/mol}$=0.2mol,而锰由+4价变成+3价,1mol转移1mol电子,则是0.2mol转移0.2mol的电子,所以转移电子数目为:0.2NA,
故答案为:Zn;2MnO2;2;Mn2O3;ZnCl2;H2O;MnO2;2;MnO2;Zn;0.2;
(3)锌片改为锌粉,固体表面积增大,反应速率增大,故答案为:使反应面积增大,提高放电效率;
(4)电化学腐蚀较化学腐蚀更快,锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀.题目中a和d选项不能除去杂质离子,c项会引入新杂质,所以应选Zn将Cu2+ 置换为单质而除去.故答案为:锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀;b;
(5)阴极上得电子,发生还原反应,H+得电子生成氢气.因为MnSO4~MnO2~2 e-,通过2mol电子产生1molMnO2,其质量为87g.故答案为:2H++2e-═H2↑;87g.
点评 本题是将典型的实验知识与原电池原理、电解原理相融合的题型,涉及了电极材料分析、电解液净化及相关电化学计算等内容,具有较宽的知识覆盖面.学∰∯习中要电化学基础知识掌握扎实.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案| A. | $\frac{{Q}_{3}-{Q}_{2}}{{Q}_{1}-{Q}_{3}}$ | B. | $\frac{{Q}_{1}-{Q}_{3}}{{Q}_{3}-{Q}_{2}}$ | C. | $\frac{{Q}_{3}-{Q}_{2}}{{Q}_{1}-{Q}_{2}}$ | D. | $\frac{{Q}_{1}-{Q}_{3}}{{Q}_{1}-{Q}_{2}}$ |
| A. | KCl | B. | Na2O2 | C. | KOH | D. | H2O |
| A. | Na、Al、Mg | B. | Be、B、Li | C. | Li、Na、K | D. | O、F、N |

| A. | 该反应是放热反应 | |
| B. | 断裂2 mol A-B 键需要吸收y kJ的能量 | |
| C. | 断裂1 mol A-A 键和1 mol B-B 键放出x kJ能量 | |
| D. | 1 mol A2和1 mol B2的总能量高于2 mol AB的总能量 |

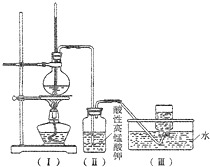 如图,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中出现棕色、黑色现象.过一段时间后,发现硫酸酸化的高锰酸钾溶液褪色.甲同学认为酸性高锰酸钾溶液褪色,能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为酸性高锰酸钾溶液褪色,不能证明乙烯被酸性高锰酸钾溶液氧化了.
如图,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中出现棕色、黑色现象.过一段时间后,发现硫酸酸化的高锰酸钾溶液褪色.甲同学认为酸性高锰酸钾溶液褪色,能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为酸性高锰酸钾溶液褪色,不能证明乙烯被酸性高锰酸钾溶液氧化了.