题目内容
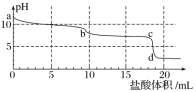
【题目】草酸(H2C2O4)是二元弱酸,NaHC2O4溶液呈酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系错误的是( )
A.V(NaOH) = 0时,c(H+) >1×10-7mol/L
B.V(NaOH)<10 mL时,可能存在c(Na+) = 2c(C2O42-)+c(HC2O4- )
C.V(NaOH) = 10 mL时,溶液的pH为9,则10-9= 10-5-2c(H2C2O4)-c(HC2O4-)
D.V(NaOH)>10 mL时,可能存在c(OH- )>c(Na+)>c(C2O42-)
【答案】D
【解析】
![]() ,10 mL 0.01 mol/L
,10 mL 0.01 mol/L![]() 溶液中滴加10 mL 0.01 mol/L
溶液中滴加10 mL 0.01 mol/L![]() 溶液时,溶质恰好为
溶液时,溶质恰好为![]() 。
。
A.![]() 时,溶液为
时,溶液为![]() 溶液,呈酸性,
溶液,呈酸性,![]() ,A正确;
,A正确;
B.![]() 时,溶液为
时,溶液为![]() 和
和![]() 的混合溶液,溶液有可能显中性,若显中性,根据电荷守恒则有
的混合溶液,溶液有可能显中性,若显中性,根据电荷守恒则有![]() ,B正确;
,B正确;
C.![]() 时,溶液为
时,溶液为![]() 溶液,质子守恒为:
溶液,质子守恒为:![]() ,溶液的pH为9,即
,溶液的pH为9,即![]() 、
、![]() ,故
,故![]() ,C正确;
,C正确;
D.![]() 时,溶液为
时,溶液为![]() 和
和![]() 溶液的混合溶液,
溶液的混合溶液,![]() ,D错误;
,D错误;
答案选D。

练习册系列答案
相关题目