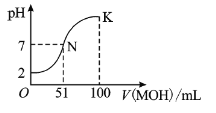
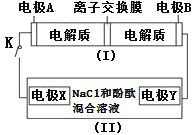
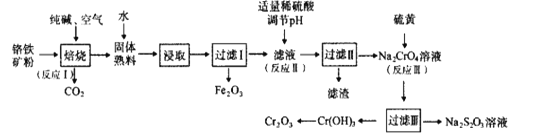
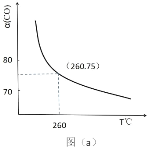
题目内容
【题目】如图为Lil晶体锂电池的工作示意图,该电池具有使用寿命长、电压稳定等优点,常用于心脏起搏器的电源。下列说法错误的是( )
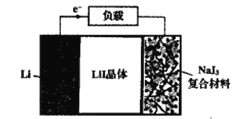
A.NaI3为电池的正极材料
B.电池工作时,Li+由NaI3移动到Li电极
C.正极电极反应为:2Li++NaI3+2e-=2LiI+NaI
D.该电池的总反应为:2Li+NaI3=2LiI+NaI
【答案】B
【解析】
A.金属锂作负极,NaI3为电池的正极材料,故A正确;
B.此装置为原电池,原电池中阳离子移向正极,Li+由Li移动到NaI3电极,故B错误;
C.由于Li+由Li移动到NaI3电极,故正极电极反应为:2Li++NaI3+2e-=2LiI+NaI,故C正确;
D.负极反应为2Li-2e-=2 Li+,2Li++NaI3+2e-=2LiI+NaI,该电池的总反应为:2Li+NaI3=2LiI+NaI,故D正确;
答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目