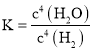题目内容
【题目】硫及其化合物在生产、生活中有着重要的应用价值。请按要求回答下列问题。
(1)如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统![]() Ⅰ
Ⅰ![]() 和系统
和系统![]() Ⅱ
Ⅱ![]() 制氢的热化学方程式分别为______;______;制得等量
制氢的热化学方程式分别为______;______;制得等量![]() 所需能量较少的是系統______。
所需能量较少的是系統______。
(2)![]() 与
与![]() 在高温下发生反应:
在高温下发生反应:![]() 。在
。在![]() 时,将
时,将![]() 与
与![]() 充入
充入![]() 的空钢瓶中。
的空钢瓶中。
①该反应平衡后![]() 的物质的量分数为
的物质的量分数为![]() ,
,![]() 的平衡转化率
的平衡转化率![]() ______,反应平衡常数
______,反应平衡常数![]() ______。
______。
②在![]() 重复试验,平衡后
重复试验,平衡后![]() 的物质的量分数为
的物质的量分数为![]() ,
,![]() 的转化率a2______a1,
的转化率a2______a1,![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 该反应的
该反应的![]() ______0。
______0。
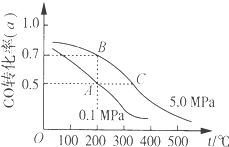
③测定钢铁中硫含量:将钢铁中的硫转化为![]() ,然后用一定浓度的
,然后用一定浓度的![]() 溶液进行滴定,所用指示剂为______,滴定反应的离子方程式为______。
溶液进行滴定,所用指示剂为______,滴定反应的离子方程式为______。
已知![]() 时,
时,![]() 的电离常数
的电离常数![]() ,
,![]() ,则该温度下
,则该温度下![]() 的水解平衡常数
的水解平衡常数![]() ______。若向
______。若向![]() 溶液中加入少量的
溶液中加入少量的![]() ,则溶液中
,则溶液中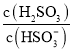 将______
将______![]() 填“增大”、“减小”或“不变“
填“增大”、“减小”或“不变“![]() 。
。
【答案】![]()
![]() 系统
系统![]() Ⅱ
Ⅱ![]()
![]()
![]()
![]()
![]() 淀粉溶液
淀粉溶液 ![]()
![]() 增大
增大
【解析】
![]() 系统
系统![]() Ⅰ
Ⅰ![]() 涉及水的分解,系统
涉及水的分解,系统![]() Ⅱ
Ⅱ![]() 涉及硫化氢的分解,利用盖斯定律分别将系统
涉及硫化氢的分解,利用盖斯定律分别将系统![]() Ⅰ
Ⅰ![]() 和系统
和系统![]() Ⅱ
Ⅱ![]() 的热化学方程式相加,可得到水、硫化氢分解的热化学方程式;
的热化学方程式相加,可得到水、硫化氢分解的热化学方程式;
![]()
![]() 转化率
转化率![]() ;平衡常数
;平衡常数![]() ;
;
![]() 根据题目提供的数据可知温度由
根据题目提供的数据可知温度由![]() 升高到
升高到![]() 时,化学反应达到平衡,水的物质的量分数由
时,化学反应达到平衡,水的物质的量分数由![]() 变为
变为![]() ,所以
,所以![]() 的转化率增大,
的转化率增大,![]() ;根据题意可知:升高温度,化学平衡向正反应方向移动;
;根据题意可知:升高温度,化学平衡向正反应方向移动;
![]() 因为
因为![]() 遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂;根据氧化还原反应书写化学方程式;根据
遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂;根据氧化还原反应书写化学方程式;根据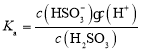 ,
, ,代入数据进行计算。
,代入数据进行计算。
![]() 系统
系统![]() Ⅰ
Ⅰ![]() 涉及水的分解,系统
涉及水的分解,系统![]() Ⅱ
Ⅱ![]() 涉及硫化氢的分解,利用盖斯定律分别将系统
涉及硫化氢的分解,利用盖斯定律分别将系统![]() Ⅰ
Ⅰ![]() 和系统
和系统![]() Ⅱ
Ⅱ![]() 的热化学方程式相加,可得到水、硫化氢分解的热化学方程式,则系统
的热化学方程式相加,可得到水、硫化氢分解的热化学方程式,则系统![]() 的热化学方程式
的热化学方程式![]() ;系统
;系统![]() 的热化学方程式
的热化学方程式![]() ;根据系统I、系统II的热化学方程式可知:每反应产生1mol氢气,后者吸收的热量比前者少,所以制取等量的
;根据系统I、系统II的热化学方程式可知:每反应产生1mol氢气,后者吸收的热量比前者少,所以制取等量的![]() 所需能量较少的是系统II。
所需能量较少的是系统II。
故答案为:![]() ;
;![]() ;系统
;系统![]() Ⅱ
Ⅱ![]() ;
;
![]() 对于反应
对于反应
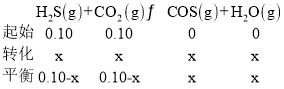
反应平衡后水的物质的量分数为![]() ,则
,则![]() ,
,![]() ,
,
![]() 的平衡转化率
的平衡转化率![]() ,
,
体积为![]() ,则平衡时各物质的浓度为
,则平衡时各物质的浓度为![]() ,
,![]() ,
,![]() ,则
,则![]() ;
;
故答案为:![]() ;
;![]() ;
;
![]() 根据题目提供的数据可知温度由
根据题目提供的数据可知温度由![]() 升高到
升高到![]() 时,化学反应达到平衡,水的物质的量分数由
时,化学反应达到平衡,水的物质的量分数由![]() 变为
变为![]() ,所以
,所以![]() 的转化率增大,
的转化率增大,![]() ;根据题意可知:升高温度,化学平衡向正反应方向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,所以该反应的正反应为吸热反应,故
;根据题意可知:升高温度,化学平衡向正反应方向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,所以该反应的正反应为吸热反应,故![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
![]() 因为
因为![]() 遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂,滴定终点时溶液的颜色变化为无色变为蓝色,反应的离子方程式为
遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂,滴定终点时溶液的颜色变化为无色变为蓝色,反应的离子方程式为![]() ;
;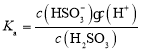 ,
,![]() ,
,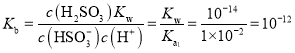 ,当加入少量
,当加入少量![]() 时,碘把弱酸
时,碘把弱酸![]() 亚硫酸
亚硫酸![]() 氧化成强酸
氧化成强酸![]() 硫酸、氢碘酸
硫酸、氢碘酸![]() ,溶液酸性增强,
,溶液酸性增强,![]() 增大,但是温度不变,Kh不变,则
增大,但是温度不变,Kh不变,则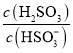 将增大;
将增大;
故答案为:淀粉溶液;![]() ;
;![]() ;增大;
;增大;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】![]() 时,在
时,在![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如下表所示。下列说法不正确的是
的浓度随时间变化如下表所示。下列说法不正确的是
时间 |
|
|
|
| 6 | 0 | ? |
| 3 | 1 |
|
A.![]() 时间内
时间内![]()
B.![]() 时,若升高温度或再充入
时,若升高温度或再充入![]() 气体,都可以提高
气体,都可以提高![]() 的转化率
的转化率
C.![]() 时,
时,![]() 正
正![]() 逆
逆![]()
D.![]() 时,平衡常数
时,平衡常数![]() ,
,![]() 与
与![]() 的转化率相等
的转化率相等
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是
A. 此时刻正反应速率大于逆反应速率
B. 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大
C. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
D. a=1.64
【题目】T ℃时,在容积为2 L的3个恒容密闭容器中发生反应:3A(g)+B(g)![]() nC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
nC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物的投入量 | 3 mol A、2 mol B | 6 mol A、4 mol B | 2 mol C |
达到平衡的时间/min | 5 | 8 | |
A的浓度/mol·L-1 | c1 | c2 | |
C的体积分数% | w1 | w3 | |
混合气体的密度/g·L-1 | ρ1 | ρ2 |
下列说法正确的是( )
A. 若n<4,则2c1<c2
B. 若n=4,则w3=w1
C. 无论n的值是多少均有2ρ1=ρ2
D. 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短