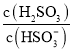题目内容
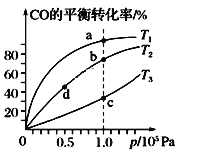
【题目】向体积均为2 L的两个恒容密闭容器中分别充入1molSiHCl3,维持容器的温度分别为T1℃和T2℃不变,发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g) ΔH1=a kJ·mol1。反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是
SiH2Cl2(g)+SiCl4(g) ΔH1=a kJ·mol1。反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是

A.T1>T2
B.T1℃时,0~100min反应的平均速率v(SiHCl3)=0.001mol·(L·min)-1
C.T2℃时,反应的平衡常数:K=1/64
D.T2℃时,使用合适的催化剂,可使SiHCl3的平衡转化率与T1℃时相同
【答案】AC
【解析】
A. “先拐先平数值大”,升高温度,化学反应速率会增大,达到平衡的时间会缩短,图中可看出T1>T2,A项正确;
B. T1℃时,0~100min SiHCl3的转化率为10%,反应的平均速率v(SiHCl3)=![]() =0.0005mol·(L·min)-1,B项错误;
=0.0005mol·(L·min)-1,B项错误;
C. 从图中信息可以看出,T2℃时达到平衡SiHCl3的转化率为20%,则:
2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)
SiH2Cl2(g)+SiCl4(g)
起始量(mol/L) 0.5 0 0
转化量(mol/L) 0.1 0.05 0.05
平衡量(mol/L) 0.4 0.05 0.05,
则平衡常数K=![]() =1/64,C项正确;
=1/64,C项正确;
D. 催化剂不会使平衡移动,不会改变SiHCl3的平衡转化率,D项错误;
答案选AC。

【题目】在某一容积为5 L的密闭容器中,进行如下化学反应: CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T /℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =______________。
(2)该反应为____________反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是________________。
a 容器中压强不变 b 混合气体中 c(CO)不变
c υ正(H2)=υ逆(H2O) d c (CO2)=c (CO)
(4)830℃下,若物质的浓度关系是c (CO2)·c (H2) > c (CO)·c (H2O),则此时正反应速率与逆反应速率的关系是____________。
a υ正 > υ逆 b υ正 = υ逆 c υ正 < υ逆 d 无法判断
(5)若开始时向该容器中加入CO2和H2各0.1 mol,在830℃和催化剂存在的条件下,反应达到平衡时,水蒸气的物质的量浓度c(H2O)=_______________。
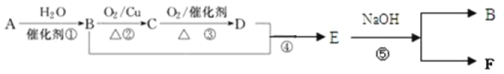
【题目】由碳酸锰矿(主要成分MnCO3,还含有FeCO3、MnO2、Al2O3、SiO2等)中提取金属锰的一种流程如下:

(1) “酸浸”过程中,提高锰元素浸出率的措施有:适当提高酸的浓度、________________(填一种)。
(2) 保持其他条件不变,在不同温度下对碳酸锰矿进行酸浸,锰元素的浸出率随时间变化如下图所示,则酸浸的最佳温度和时间分别是________。

提取过程中相关金属离子生成氢氧化物沉淀的pH
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.8 |
(3) 已知“酸浸”后溶液中锰元素只以Mn2+形式存在,则“酸浸”中发生氧化还原反应的离子方程式为________________________________________。
(4) 结合上表,“除铁、铝”时加入氨水控制反应液pH的范围为________。
(5) 若上述流程中加入的H2O2不足量,则待电解溶液中会有铁元素残余,进而会影响最终锰的纯度。请设计简要实验方案加以验证待电解溶液中是否含有铁元素: _________________。
(6) 以石墨为电极电解除铁、铝后的溶液获得单质锰。电解废液中可循环利用的溶质是________。