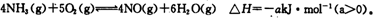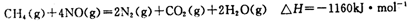题目内容
氨气在科研、生产中有广泛应用。
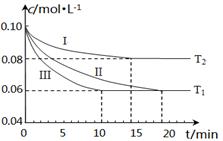
(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g) 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
①实验Ⅲ在前10分钟内N2平均反应速率v(N2)= ;(写出计算过程)
②与实验Ⅱ相比,实验Ⅰ、实验Ⅲ分别采用的实验条件可能为 、 。
(2)常温下NH4+(aq)+H2O(l) NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3?H2O的电离平衡常数K= (保留三位有效数字)。
NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3?H2O的电离平衡常数K= (保留三位有效数字)。
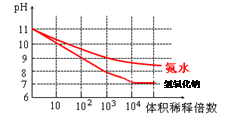
(3)常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在右图中画出两溶液的pH随体积稀释倍数的变化曲线(加必要标注)。
(4)工业上用NH3消除NO污染。在一定条件下,已知每还原1molNO,放出热量120kJ,请完成下列热化学方程式: NO(g)+ NH3(g)= N2(g)+ (g) ΔH2= 。


(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g)
 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。①实验Ⅲ在前10分钟内N2平均反应速率v(N2)= ;(写出计算过程)
②与实验Ⅱ相比,实验Ⅰ、实验Ⅲ分别采用的实验条件可能为 、 。
(2)常温下NH4+(aq)+H2O(l)
 NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3?H2O的电离平衡常数K= (保留三位有效数字)。
NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3?H2O的电离平衡常数K= (保留三位有效数字)。(3)常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在右图中画出两溶液的pH随体积稀释倍数的变化曲线(加必要标注)。
(4)工业上用NH3消除NO污染。在一定条件下,已知每还原1molNO,放出热量120kJ,请完成下列热化学方程式: NO(g)+ NH3(g)= N2(g)+ (g) ΔH2= 。
(1)①v(N2)=" Δ" c (N2) /Δt="(0.10-0.06" )mol·L-1/10min=0.004(或4×10-3) mol·L-1·min-1(代数式1分,结果表达1分,带单位运算1分。共3分) ②升高温度、使用催化剂(各2分,共4分)
(2)1.80×10-5mol·L-1(2分,无单位扣1分)。
(3)(见右图)(2分)
(4)6NO(g)+4NH3(g)=5N2(g)+6H2O(g) (2分)ΔH2=-720 kJ/mo1。(2分,没负号扣1分)
或者3NO(g)+2NH3(g)=5/2N2(g)+3H2O(g) ΔH2=-360 kJ/mo1
(2)1.80×10-5mol·L-1(2分,无单位扣1分)。
(3)(见右图)(2分)

(4)6NO(g)+4NH3(g)=5N2(g)+6H2O(g) (2分)ΔH2=-720 kJ/mo1。(2分,没负号扣1分)
或者3NO(g)+2NH3(g)=5/2N2(g)+3H2O(g) ΔH2=-360 kJ/mo1
试题分析: (1)①从图像可以看出10分钟内氮气的变化量,因此反应速率v(N2)=Δ c (N2) /Δt="(0.10-0.06" )mol·L-1/10min=0.004(或4×10-3) mol·L-1·min-1 ;
②与实验II相比,曲线I更快达到平衡,但氮气的平衡转化率要低,而该反应是吸热反应,因此改变的条件应该是升高了反应的温度;与实验II相比,曲线III反应速率也更快达到平衡,但是平衡转化率不同,因此改变的条件应该是加入了催化剂。
(2)已知的反应式为NH4+ 的水解平衡式,该反应式可以由水的电力平衡式和氨水的电离平衡式结合而得,因此现在要求氨水的电离平衡,只要用水的电力平衡式H2O(l)
 H+(aq)+OH-(aq)减去已知的水解平衡式即可,相应的平衡常数K(NH3?H2O)=Kw/Kh=1×10-14 /5.55×10-10 =1.80×10-5 mol·L-1 。
H+(aq)+OH-(aq)减去已知的水解平衡式即可,相应的平衡常数K(NH3?H2O)=Kw/Kh=1×10-14 /5.55×10-10 =1.80×10-5 mol·L-1 。(3)pH相同的弱碱和强碱溶液稀释,前阶段强碱溶液的pH值等倍数的降低,弱碱溶液边稀释边电离pH降低比强碱要慢,后阶段稀释接近无限稀释,因此溶液的pH值均不再等倍数降低,而是无限的接近7,但是碱溶液始终是碱溶液,pH值不能等于7。因此曲线如图所示。

(4)用氨气做还原剂还原污染物NO,此处氨气中N的化合价由-3→0价,NO中N的化合价由+2→0价,因此根据得失电子守恒配平方程式为6NO(g)+4NH3(g)=5N2(g)+6H2O(g),方程式中NO的系数是6,表示还原NO为6mol,因此热效应ΔH2=6×120kJ=720kJ/mol。由于热化学方程式中系数可以是分数,因此答案也可以是3NO(g)+2NH3(g)=5/2N2(g)+3H2O(g) ΔH2=-360 kJ/mo1。

练习册系列答案
相关题目

 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大
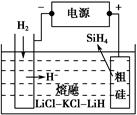
2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 Si(s)+3HCl(g)。
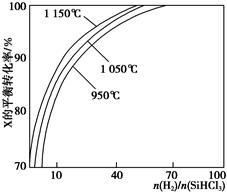
Si(s)+3HCl(g)。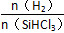 时,反应物X的平衡转化率关系如图所示。
时,反应物X的平衡转化率关系如图所示。