题目内容
材料是人类赖以生存的重要物质基础.通常可分为金属材料、无机非金属
材料、高分子合成材料及复合材料.
(1)锂电池的质量轻,电容量大,颇受手机、手提电脑等制造商的青睐.某种锂电池的总反应式为Li+MnO2=LiMnO2,其中被氧化的元素是______.
(2)全世界每年因生锈损失的钢铁约占世界钢铁年产量的1/4.______(填“化学腐蚀”或“电化学腐蚀”)是钢铁发生最普遍的腐蚀.
(3)请为以下钢铁制品选择适当的防锈方法:
A.自行车的链条______
B.轮船的船体______
(4)无机非金属材料主要包括玻璃、水泥和______.塑料、合成橡胶和______是常说的三大合成材料.
(5)由酚醛树脂和玻璃纤维制成的复合材料--玻璃钢具有______、______(写出两点即可)等优异性能.
材料、高分子合成材料及复合材料.
(1)锂电池的质量轻,电容量大,颇受手机、手提电脑等制造商的青睐.某种锂电池的总反应式为Li+MnO2=LiMnO2,其中被氧化的元素是______.
(2)全世界每年因生锈损失的钢铁约占世界钢铁年产量的1/4.______(填“化学腐蚀”或“电化学腐蚀”)是钢铁发生最普遍的腐蚀.
(3)请为以下钢铁制品选择适当的防锈方法:
A.自行车的链条______
B.轮船的船体______
(4)无机非金属材料主要包括玻璃、水泥和______.塑料、合成橡胶和______是常说的三大合成材料.
(5)由酚醛树脂和玻璃纤维制成的复合材料--玻璃钢具有______、______(写出两点即可)等优异性能.
(1)失电子化合价升高的元素被氧化,该反应中,Li元素化合价由0价变为+1价,所以Li元素被氧化,故答案为:Li;
(2)钢铁中含有铁、碳,和合适的电解质溶液构成原电池而产生电流,属于电荷腐蚀,所以钢铁易发生电化学腐蚀,故答案为:电化学腐蚀;
(3)防止铁生锈的方法有:涂油、牺牲阳极的阴极保护法、外加电流的阴极保护法、电镀金属、制成不锈钢等,A自行车链条一般采用涂油的方法防止铁被腐蚀,涂油较方便操作;B轮船船体体积较大且要定期进行保护,一般采用在轮船船身上装上一定数量的锌块,即采用牺牲阳极的阴极保护法,
故答案为:涂油;在轮船船身上装上一定数量的锌块;
(4)无机非金属材料主要包括玻璃、水泥、陶瓷,它们都是传统硅酸盐产品,合成材料有:合成纤维、合成橡胶、塑料,这些合成材料在生产、生活中起了很大作用,故答案为:陶瓷;合成纤维;
(5)玻璃钢属于非金属合成材料,玻璃钢具有密度小、强度高、耐腐蚀、电绝缘、易加工等优异性能,所以被广泛应用,故答案为:密度小、强度高.
(2)钢铁中含有铁、碳,和合适的电解质溶液构成原电池而产生电流,属于电荷腐蚀,所以钢铁易发生电化学腐蚀,故答案为:电化学腐蚀;
(3)防止铁生锈的方法有:涂油、牺牲阳极的阴极保护法、外加电流的阴极保护法、电镀金属、制成不锈钢等,A自行车链条一般采用涂油的方法防止铁被腐蚀,涂油较方便操作;B轮船船体体积较大且要定期进行保护,一般采用在轮船船身上装上一定数量的锌块,即采用牺牲阳极的阴极保护法,
故答案为:涂油;在轮船船身上装上一定数量的锌块;
(4)无机非金属材料主要包括玻璃、水泥、陶瓷,它们都是传统硅酸盐产品,合成材料有:合成纤维、合成橡胶、塑料,这些合成材料在生产、生活中起了很大作用,故答案为:陶瓷;合成纤维;
(5)玻璃钢属于非金属合成材料,玻璃钢具有密度小、强度高、耐腐蚀、电绝缘、易加工等优异性能,所以被广泛应用,故答案为:密度小、强度高.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目



 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。 NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3?H2O的电离平衡常数K= (保留三位有效数字)。
NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3?H2O的电离平衡常数K= (保留三位有效数字)。 2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小
2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小
 2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
 0(填“>’或“<”)。
0(填“>’或“<”)。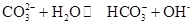 ,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。
,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。