题目内容
下列有关说法正确的是
| A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0 |
| B.镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反 |
C.对于N2(g)+3H2(g) 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 |
| D.100℃时水的离子积常数Kw为5.5×10-13,说明水的电离是放热反应 |
C
试题分析:A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,是因为该反应是体系混乱程度增大的反应。错误。B.镀锌铁制品镀层破损后,由于锌活动性比铁强,Zn、Fe及周围的水膜构成原电池,Zn作负极,任然能对Fe起到保护作用;而镀锡铁镀层破坏后,Sn、Fe及水膜也构成原电池,由于Fe的活动性比Sn强,Fe作负极,首先被腐蚀,所以铁制品比受损前更容易生锈。错误。C.由于该反应的正反应是气体体积减小的反应,当其他条件不变时,压缩气体体积使压强增大,各种物质的浓度都增大,所以正反应和逆反应速率都加快。根据平衡移动原理:增大压强,化学平衡向气体体积减小的反应方向移动,即向正反应方向移动,所以H2的平衡转化率增大。正确。D.25℃时水的离子积常数Kw为1.0×10-14,100℃时水的离子积常数Kw为5.5×10-13,温度升高Kw增大,说明升高温度促进水的电离,因此水的电离是吸热过程。错误。

练习册系列答案
相关题目
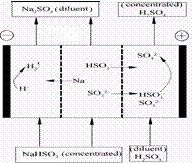



 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。 NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3?H2O的电离平衡常数K= (保留三位有效数字)。
NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3?H2O的电离平衡常数K= (保留三位有效数字)。 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大
2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大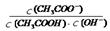 的值不变
的值不变 2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小
2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小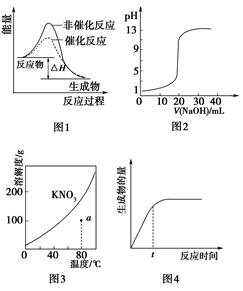
 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0