题目内容
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位。工业制硝酸的主要反应之一是
(1)如果将4mol NH3和5mol O2放入容器中,达到平衡时放出热量0.8akJ,则平衡时NH3的转化率为 。
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO的浓度与时间关系如图所示,则NO的a、b、c三点的反应速率v(a正)、v(b逆)、v(c正)的大小关系是 。

(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:

①第2min到第4mim,反应速率v(O2)= ;
②第2min时改变了条件,改变的条件可能是 (从所给选项中选择);
③在与第4min相同的温度下,若起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为2moI/L,则该反应 (填“正反应方向进行”、“逆反应方向进行”、“不移动”)。
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。尿素(H2NCONH2)是一种非常重要的高氮化肥,在温度70—95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2三者等物质的量反应的化学方程式为 。
(5)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:


则1mol甲烷直接将NO2还原为N2的烩变为____ 。

(1)如果将4mol NH3和5mol O2放入容器中,达到平衡时放出热量0.8akJ,则平衡时NH3的转化率为 。
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO的浓度与时间关系如图所示,则NO的a、b、c三点的反应速率v(a正)、v(b逆)、v(c正)的大小关系是 。

(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:

①第2min到第4mim,反应速率v(O2)= ;
②第2min时改变了条件,改变的条件可能是 (从所给选项中选择);
| A.降低温度 | B.增加了生成物 | C.减小压强 | D.使用了高效催化剂 |
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。尿素(H2NCONH2)是一种非常重要的高氮化肥,在温度70—95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2三者等物质的量反应的化学方程式为 。
(5)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:


则1mol甲烷直接将NO2还原为N2的烩变为____ 。
(14分,每空2分)(1)80% (2)υ(a正)>υ(b逆)=υ(c正)
(3)①0.75mol/(L·min)(不带单位给1分) ②D ③正反应方向进行
(4)CO(NH2)2+NO+NO2 CO2+2N2+2H2O
CO2+2N2+2H2O
(5)△H=-867kJ/mol(或-867kJ·mol-1)(无负号不给分)
(3)①0.75mol/(L·min)(不带单位给1分) ②D ③正反应方向进行
(4)CO(NH2)2+NO+NO2
 CO2+2N2+2H2O
CO2+2N2+2H2O(5)△H=-867kJ/mol(或-867kJ·mol-1)(无负号不给分)
试题分析:(1)根据热化学方程式可知,若达到平衡时放出热量0.8akJ,则消耗氨气的物质的量是
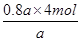 =3.2mol,所以氨气的转化率是
=3.2mol,所以氨气的转化率是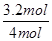 ×100%=80%。
×100%=80%。(2)根据图像可知,a点煤油达到平衡状态,b和c点NO的浓度不再发生变化,属于平衡状态,因此NO的a、b、c三点的反应速率v(a正)、v(b逆)、v(c正)的大小关系是υ(a正)>υ(b逆)=υ(c正)。
(3)①根据表中数据可知,第2min到第4mim内氧气的浓度减少了4.5mol/L-3.0mol=1.5mol/L,所以反应速率v(O2)=1.5mol/L÷2min=0.75mol/(L·min)。
②根据表中数据可知,前2分钟内氧气的浓度减少5.5mol/L-4.5mol=1.0mol/L,即第2min时反应速率明显高于前2分钟的反应速率,所以改变的条件可能是使用了高效催化剂,答案选D。
③根据表中数据可知,平衡时NH3、O2、NO和H2O(g)的浓度(2moI/L)分别是2.0、3.0、2.0、3.0,所以该温度下反应的平衡常数K=
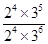 =
=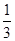 。如果起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为2moI/L,则此时Q=
。如果起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为2moI/L,则此时Q=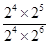 =0.5>
=0.5>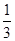 ,所以该反应正反应方向进行。
,所以该反应正反应方向进行。(4)根据原子守恒可知,反应中除了生成氮气以外,还有CO2和水产生,则该反应的化学方程式是CO(NH2)2+NO+NO2
 CO2+2N2+2H2O。
CO2+2N2+2H2O。(5)根据盖斯定律可知,两式相加即得到2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g),所以该反应的反应热△H=-574kJ/mol-1160kJ/mol=-1734kJ/mol,则1mol甲烷直接将NO2还原为N2的烩变为△H=-1734kJ/mol÷2=-867kJ/mol。

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目


 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。 NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3?H2O的电离平衡常数K= (保留三位有效数字)。
NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3?H2O的电离平衡常数K= (保留三位有效数字)。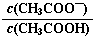 的值减小
的值减小
 2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
 0(填“>’或“<”)。
0(填“>’或“<”)。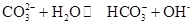 ,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。
,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。 2SO3反应,增大压强,平衡会正向移动,
2SO3反应,增大压强,平衡会正向移动,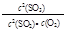 的值增大
的值增大
 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0 H2+I2
H2+I2
 PCl5(g) ΔH= -93kJ?mol—1 ,达平衡时放热139.5kJ,则PCl3的转化率为75%
PCl5(g) ΔH= -93kJ?mol—1 ,达平衡时放热139.5kJ,则PCl3的转化率为75%