题目内容
19.已两种气态烃以任意比例混合,在105℃时,1L该混合烃与9L氧气混合,充分燃烧,恢复到原状态,所得气体仍为10L,则这两种烃不可能是( )| A. | CH4和C2H4 | B. | CH4和C3H6 | C. | C2H4和C3H4 | D. | C2H2和C3H6 |
分析 有机物燃烧前后体积不变,可设有机物的平均式为CxHy,根据燃烧的方程式CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O计算分子组成特点,进而对各选项进行推断.
解答 解:设有机物的平均式为CxHy,则有:CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O,有机物燃烧前后体积不变,
则:1+x+$\frac{y}{4}$=x+$\frac{y}{2}$,
解得:y=4,
即混合气中平均含有H原子数为4,
A.CH4、C2H4中H原子数都为4,平均值为4;
B.CH4、C3H6中H原子数分别为4、6,平均值不可能为4;
C.C2H4、C3H4中H原子数都为4,平均值为4;
D.C2H2和C3H6分子中氢原子数分别为都是2、6,比例不同,氢原子数不同,则氢原子数的平均值不一定为4;
根据分析可知,可能的为AC,不可能的为BD,
故选BD.
点评 本题考查了混合物反应的计算,题目难度中等,注意掌握有机物燃烧的通式,明确平均值法在化学计算中的应用,试题侧重考查学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.在一定温度下,恒容的密闭容器中,可逆反应X(g)+3Y(g)?2Z(g)达到平衡(反应最大限度)的标志是( )
| A. | X、Y、Z的浓度不再发生变化 | |
| B. | X、Y、Z三种物质体积分数均相等 | |
| C. | 气体总质量保持不变 | |
| D. | 单位时间消耗3molY,同时生成2molZ |
7.某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
试根据表中的实验现象回答下列问题:
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)实验3中负极反应式:2Al-6e-═2Al3+;
总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,电极反应式Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)实验3中负极反应式:2Al-6e-═2Al3+;
总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,电极反应式Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
4.下列有关说法不正确的是( )
| A. | 要清洗附着在试管壁上的硫,可用的试剂是CS2 | |
| B. | 硫化亚铁溶于稀硝酸中反应的化学方程式为:FeS+2HNO3→Fe(NO3)2+H2S↑ | |
| C. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸 | |
| D. | 在Na2SO3和BaCO3混合物中加入过量的稀硫酸,能产生气泡并有沉淀生成 |
11.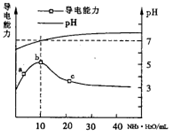 常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,
常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,
所得溶液pH及导电性变化如图.下列分析不正确的是( )
 常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,
常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )
| A. | a~b点导电能力增强说明HR为弱酸 | |
| B. | b点溶液pH=7说明NH4R没有水解 | |
| C. | c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b-c任意点溶液均有c(H+)×c(OH-)=KW=1.0×10-14 |

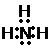 、E的结构式H-O-H、F的化学式为Fe3O4.
、E的结构式H-O-H、F的化学式为Fe3O4.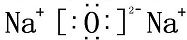 NaOH
NaOH Na2O2
Na2O2
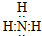 CO2
CO2 HClO
HClO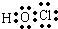 .
.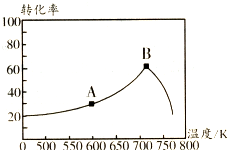 碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放.已知如下信息:
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放.已知如下信息: