题目内容
16.按要求填空:(1)Al原子结构示意图
 ;该元素位于第三周期,第ⅢA族.
;该元素位于第三周期,第ⅢA族.(2)写出N2的结构式N≡N,N2含有非极性键(填“极性”或“非极性”).
分析 (1)原子结构示意图是表示原子核电荷数和电子层排布的图示形式,小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数,根据核外电子排布规律确定各层电子数,画出原子结构示意图,对于主族元素,周期数=电子层数,族序数=最外层电子数,据此判断该元素在周期表中位置;
(2)N2 分子中,两个氮原子各拿出3个电子形成3对共用电子对;由同种元素的原子形成共价键为非极性键.
解答 解:(1)Al原子序数为13的元素,质子数为13,核外电子数为13,有3个电子层,最外层有3个电子,原子结构示意图为 ,主族元素周期数=电子层数,族序数=最外层电子数,所以铝元素位于周期表中第三周期第ⅢA族,
,主族元素周期数=电子层数,族序数=最外层电子数,所以铝元素位于周期表中第三周期第ⅢA族,
故答案为: ;三;ⅢA;
;三;ⅢA;
(2)氮气分子中存在氮氮三键,氮气的结构式为:N≡N;单质氮是由氮原子与氮原子之间构成的共价键,属于非极性共价键,
故答案为:N≡N;非极性.
点评 本题考查原子结构与位置关系、原子结构示意图、分子的结构简式、分子的极性,题目难度较小,理解核外电子排布规律是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案
相关题目
6.如图是198K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是 ( )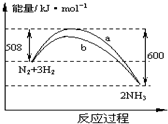

| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 加入催化剂,该化学反应的反应热改变 | |
| C. | b曲线是加入催化剂时的能量变化曲线 | |
| D. | 加入催化剂可增大正反应速率,降低逆反应速率 |
7.以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)?2CO2(g)+H2O(l)△H=-1 300kJ•mol-1的说法中,正确的是( )
| A. | 当10NA个电子转移时,该反应放出1 300 kJ的能量 | |
| B. | 当1NA个水分子生成且为液体时,吸收1300 kJ的能量 | |
| C. | 当2NA个碳氧共用电子对生成时,放出1300 kJ的能量 | |
| D. | 当4NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
4. 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )
 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )| A. | 控制温度不可以用水浴加热 | |
| B. | 长玻璃管起冷凝回流作用 | |
| C. | 提纯乙酸丁酯需要经过氢氧化钠溶液洗涤 | |
| D. | 加入过量乙酸可以提高1-丁醇的转化率 |
1.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.7 g羟基(-OH)中含有的电子数为NA | |
| B. | 标准状况下,11.2 L CCl4含有的碳原子数为0.5NA | |
| C. | 1 mol苯分子中含有的碳碳双键数为3NA | |
| D. | 常温下,28g乙烯中含有的碳原子数为2NA |
8.水溶液中能大量共存的一组离子是( )
| A. | pH=1的溶液中:Fe2+、CH3COO-、K+、SO42- | |
| B. | 在含较多Al3+的溶液中:Na+、Cl-、HCO3- | |
| C. | 在0.1 mol•L-1 CaCl2溶液中:K+、Ba2+、I-、OH- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中:K+、Na+、ClO-、NO${\;}_{3}^{-}$ |
7.某化工厂因附近采石场放炮,致使该厂异丁烯成品储罐被砸坏,造成异丁烯CH2═C(CH3)2外泄事故.有关异丁烯的下列说法错误的是( )
| A. | 异丁烯与环丁烷互为同分异构体 | |
| B. | 聚异丁烯的结构简式可表示为 | |
| C. | 异丁烯可与氯化氢反应制得2-甲基-2-氯丙烷 | |
| D. | 聚异丁烯能使溴水褪色 |




