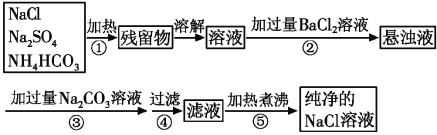
题目内容
【题目】请利用下列装置及试剂组装一套装置。其流程是,先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。试回答:(各装置位置未确定)
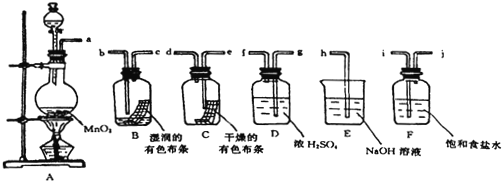
(1)烧瓶A中发生反应的化学方程式是_______________ 。
(2)E装置的作用是_______________ E装置中发生反应化学方程式是_______________。实验中若氯气的流速为每分钟2.24升,实验持续5分钟,则烧杯E中至少盛放2.5mol·L-1的氢氧化钠溶液___mL 。
(3)连接装置时,B、C的前后顺序是_______________。
(4)实验室还可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)==2KCl+ 2MnCl2+5Cl2↑ +8H2O,该反应中氧化剂和还原剂的物质的量之比为____;
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 吸收多余的氯气 Cl2+2NaOH=NaCl+NaClO+H2O 400mL 先连接C后连接B 1:5
MnCl2+Cl2↑+2H2O 吸收多余的氯气 Cl2+2NaOH=NaCl+NaClO+H2O 400mL 先连接C后连接B 1:5
【解析】
(1)烧瓶中浓盐酸与二氧化锰在加热条件下反应生成氯气、氯化锰和水,方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)氯气有毒,污染环境,所以不能直接排空;E装置的作用是:吸收多余的氯气;
氯气能和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以可用氢氧化钠溶液吸收多余的氯气;E装置中发生反应化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O;
实验中若氯气的流速为每分钟2.24升,实验持续5分钟,n(Cl2)=![]() =0.5mol,
=0.5mol,
Cl2 + 2NaOH = NaCl+NaClO+H2O
0.5mol 1mol
V(NaOH)=![]() =0.4L
=0.4L
则烧杯E中至少盛放2.5mol·L-1的氢氧化钠溶液400mL 。
(3)实验装置的连接顺序为:发生装置→除杂装置→性质检验装置→尾气处理装置;因为收集的是气体,所以除杂装置中长导管进气,短导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接饱和食盐水装置后连接浓硫酸装置;实验干燥的Cl2和潮湿的Cl2有无漂白性,因为湿润的有色布条有水分,所以D装置先连接C后连接B,顺序为a→i→j→g→f→e→d→b→c→h,
连接装置时,B、C的前后顺序是:先连接C后连接B。
(4)实验室还可以用高锰酸钾和浓盐酸反应制取氯气,2KMnO4+16HCl(浓)==2KCl+ 2MnCl2+5Cl2↑ +8H2O,该反应中氧化剂为KMnO4,还原剂是HCl,每16molHCl参加反应,还原剂只有10mol,氧化剂和还原剂的物质的量之比为2:10=1:5。