题目内容
【题目】已知液氨的性质与水相似。T ℃时,NH3+NH3![]() NH4 ++NH2-,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
NH4 ++NH2-,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
A. 在此温度下液氨的离子积为1×10-14
B. 在液氨中放入金属钠,可生成NaNH2
C. 恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D. 降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2-)
【答案】B
【解析】
A.该温度下,该物质中c(NH4+)=c(NH2-),液氨的离子积常数=c(NH4 +)c(NH2-)=(1×10-15 molL-1)2=1030,故A错误;
B.由钠与水反应可推知,2Na+2NH3=2NaNH2+H2↑,所以液氨中放入金属钠,可生成NaNH2,故B正确;
C.离子积常数只与温度有关,温度不变,离子积常数不变,故C错误;
D.弱电解质的电离是吸热反应,降低温度平衡逆向移动,但液体中仍然存在(NH4+)=c(NH2-),故D错误;
所以本题答案:B。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】研究煤的合理利用及CO2的综合应用有着重要的意义。请回答以下问题:
I.煤的气化
已知煤的气化过程涉及的基本化学反应有:
C(s)+H20(g)![]() CO(g)+H2(g) △H=+131kJ/mol
CO(g)+H2(g) △H=+131kJ/mol
②CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H=akJ/mol
CH4(g)+H2O(g) △H=akJ/mol
查阅资料反应②中相关化学键键能数据如下表:
化学键 |
| H-H | H—C | H-O |
E/(kJ/mol) | 1072 | 436 | 414 | 465 |
(1)煤直接甲烷化反应C(s)+2H2(g)![]() CH4(g)的△H为_______kJ/mol,该反应在______(填“髙温”或“低温”)下自发进行。
CH4(g)的△H为_______kJ/mol,该反应在______(填“髙温”或“低温”)下自发进行。
Ⅱ.合成低碳烯烃
在体积为1 L的密闭容器中,充入1molCO2和2.5molH2,发生反应:
2C02(g)+6H2(g)![]() C2H4(g)+4H20(g) △H=-128kJ/mol,测得温度对催化剂催化效率和 C02平衡转化率的影响如图所示:
C2H4(g)+4H20(g) △H=-128kJ/mol,测得温度对催化剂催化效率和 C02平衡转化率的影响如图所示:
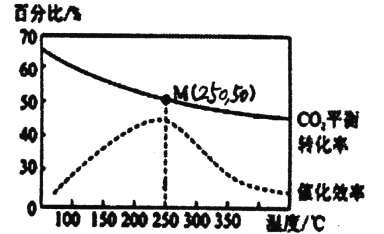
(2)图中低温时,随着温度升高催化剂的催化效率提高,但C02的平衡转化率却反而降低,其原因是__________。
(3)250℃时,该反应的平衡常数K值为__________。
Ⅲ.合成甲醇
在恒温2 L容积不变的密闭容器中,充入lmolC02和3molH2,发生反应:C02(g)+3H2(g)![]() CH30H(g)+H20(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH30H(g)+H20(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(4)反应前1小时内的平均反应速率V(H2)为_________mol/(L·h),该温度下C02的平衡转化率为_________。
IV.电解逆转化制乙醇
(5)科研人员通过反复实验发现:C02可以在酸性水溶液中电解生成乙醇,则生成乙醇的反应发生在_________极(“阴”或“阳”),该电极的反应式为_________。
【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
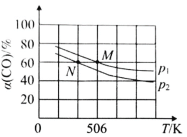
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
(3)若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是____(填字母);
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___kPamin-1。