题目内容
【题目】有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如下图所示(电极未标出),下列说法错误的是:
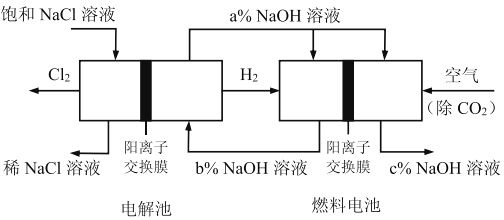
A. 电解池的阴极反应式2H2O+2e-=H2+2OH-
B. 相同条件下,当电解池生成2LCl2,理论上燃料电池应消耗1LO2
C. 电解池中阳离子移动流向阴极池
D. 溶液a、b、c的pH大小顺序为:a>b>c
【答案】D
【解析】
从图中可以看出来,左边为电解饱和食盐水的电解质,右边为氢氧燃料电池。
A.电解池的阴极得电子,产生氢气,方程式为2H2O+2e-=H2+2OH-,A项不符合题意;
B.整个电路中经过的电量是一样的,生成22.4LCl2转移2mol电子,消耗0.5molO2,物质的量之比等于气体体积之比,因此电解池生成了2LCl2,理论上燃料电池应消耗1LO2。B项不符合题意;
C.电解池中阳离子向阴极移动,C项不符合题意;
D.a%,b%,c%的氢氧化钠溶液,电解池中阴极产生NaOH,a>b,在原电池中,通入空气的一极,氧气得电子生成OH-,因此c> a;所以pH大小顺序为c> a>b;D项符合题意;
本题答案选D。
离子 | 原电池 | 电解池 |
阴离子 | 向负极移动 | 向阳极移动 |
阳离子 | 向正极移动 | 向负极移动 |

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目