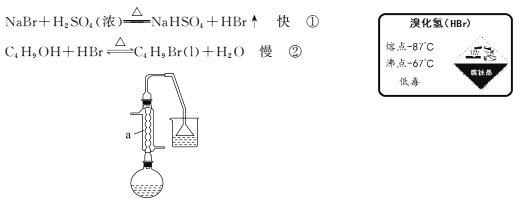
题目内容
【题目】饮用水中的NO3对人类健康会产生危害,为了降低饮用水中NO3的浓度,可以在碱性条件下用铝粉将NO3还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,被氧化的元素_________,还原产物是________。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________。
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4L N2,转移_______mol电子。
(4)请配平下列离子方程式。
____Fe2++____H+ +____NO3=____Fe3+ +____N2O↑+____H2O
【答案】Al N2 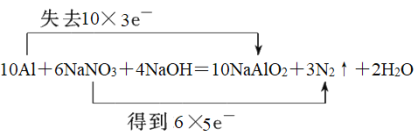 10 8 10 2 8 1 5
10 8 10 2 8 1 5
【解析】
(1)反应10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O中Al元素化合价升高,被氧化,在反应中失去电子,被氧化的元素为Al;氮元素化合价降低,硝酸钠是氧化剂,因此还原产物是N2;
(2)反应中铝失去电子数为10×3e-,NaNO3得到电子数为6×5e-,所以用“双线桥法”标明反应中电子转移的方向和数目为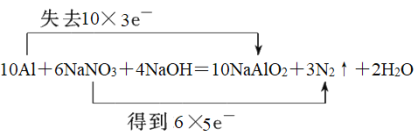 ;
;
(3)氮元素化合价从+5价降低到0价,即得到1mol氮气转移10mol电子,因此反应中每生成标况下22.4L N2即1mol,转移10mol电子。
(4)反应中铁元素化合价从+2价升高到+3价,失去1个电子。氮元素化合价从+5价降低到+1价,得到4个电子,根据电子得失守恒以及原子守恒、电荷守恒可知配平后的方程式为8Fe2++10H++2NO3=8Fe3++N2O↑+5H2O

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目