题目内容
2. 某同学通过如下实验,探究化学反应中的能量变化.
某同学通过如下实验,探究化学反应中的能量变化.(1)在试管中加入6mol/L的盐酸2mL,再插入用砂纸打磨过的铝条,用温度计测量溶液的温度,在最初的2分钟,温度由23℃上升到25℃,说明该反应是放热(填“吸热”或“放热”)反应,反应的离子方程式是2Al+6H+═2Al3++3H2↑.
(2)如图所示进行实验时,烧杯的温度降低,说明Ba(OH)2•8H2O跟NH4Cl的反应是吸热(填“吸热”或“放热”),反应中生成的有刺激性气味气体的电子式为
 ,用湿润的红色石蕊试纸检验该气体.
,用湿润的红色石蕊试纸检验该气体.
分析 (1)反应温度升高,说明该反应为放热反应,铝与盐酸反应生成氯化铝和氢气,据此写出反应的离子方程式;
(2)温度降低,说明反应为吸热反应;反应生成的刺激性气体为氨气,氨气为共价化合物,据此写出其电子式;常用湿润的红色石蕊试纸检验氨气.
解答 解:(1)在试管中加入6mol/L的盐酸2mL,再插入用砂纸打磨过的铝条,用温度计测量溶液的温度,在最初的2分钟,温度由23℃上升到25℃,反应温度升高,则该反应为放热反应,反应的离子方程式为:2Al+6H+═2Al3++3H2↑,
故答案为:放热;2Al+6H+═2Al3++3H2↑;
(2)如图所示进行实验时,烧杯的温度降低,说明Ba(OH)2•8H2O跟NH4Cl的反应是吸热反应;反应生成的气体为氨气,氨气的电子式为: ;常用湿润的红色石蕊试纸检验氨气,
;常用湿润的红色石蕊试纸检验氨气,
故答案为:吸热; ;湿润的红色石蕊试纸.
;湿润的红色石蕊试纸.
点评 本题考查了探究吸热反应与放热反应、电子式、离子方程式书写等知识,题目难度中等,注意掌握化学反应与能量变化的关系,明确常见化学用语的书写方法.

练习册系列答案
 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
13.下列装置能构成原电池的是( )
| A. | 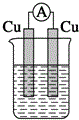 稀硫酸 | B. | 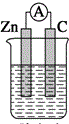 稀硫酸 | C. | 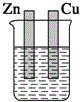 稀硫酸 | D. | 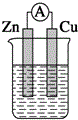 无水乙醇 |
10.纯羊毛线和聚酯纤维(结构如图)均是纺织、服装行业常用的材料.下列说法正确的是( )


| A. | 羊毛与聚酯纤维的化学成分相同 | |
| B. | 聚酯纤维和羊毛在一定条件下均能水解 | |
| C. | 该聚酯纤维的单体为对苯二甲酸和乙醇 | |
| D. | 聚酯纤维属于纯净物 |
17.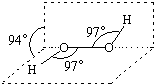 过氧化氢被称为绿色氧化剂,它的分子结构如图所示.已知该分子H-O-O键角都是97°.下列有关H2O2的说法正确的是( )
过氧化氢被称为绿色氧化剂,它的分子结构如图所示.已知该分子H-O-O键角都是97°.下列有关H2O2的说法正确的是( )
 过氧化氢被称为绿色氧化剂,它的分子结构如图所示.已知该分子H-O-O键角都是97°.下列有关H2O2的说法正确的是( )
过氧化氢被称为绿色氧化剂,它的分子结构如图所示.已知该分子H-O-O键角都是97°.下列有关H2O2的说法正确的是( )| A. | 过氧化氢分子中存在离子键、共价键 | |
| B. | 在1.00mol H2O2中,核外电子总数为10×6.02×1023个 | |
| C. | 过氧化氢既有氧化性又有还原性 | |
| D. | 3.4g过氧化氢中含有6.02×1022个原子 |
7.某同学为了测定三聚氰胺的分子式和结构简式,设计了如下实验:
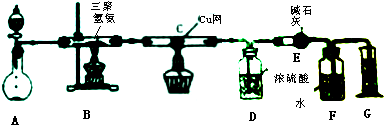
查阅资料,三聚氰胺的相对分子质量为126,三聚氰胺在常温下成晶体,在加热条件下能与氧气发生反应生成二氧化碳、氮气和水.取12.6g的三聚氰胺晶体如图装置进行实验(假设三聚氰胺完全反应转化产物).
(1)抑制A装置中固体为Na2O2,请写出其中发生反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑;
(2)D装置不能与E装置互换的理由是浓硫酸吸水,碱石灰吸收二氧化碳,若互换位置,则碱石灰会同时吸收水和二氧化碳,导致实验失败;
(3)当B装置中反应完全发生后,读取G中的体积的使用操作顺序为②③①(填序号).
①读数②冷却至室温③调平F、G装置中的液面
(4)测定数据如下:
经测定,F中收集的气体折合标准状况下的体积为6.72L.
①利用上述实验数据,计算三聚氰胺的量筒式为CN2H2;
②三聚氰胺的分子式为C3N6H6;
③若没有C装置中的铜网,对测定结果的影响是测定所得分子式的氮原子数偏大,而碳、氢原子数偏小.

查阅资料,三聚氰胺的相对分子质量为126,三聚氰胺在常温下成晶体,在加热条件下能与氧气发生反应生成二氧化碳、氮气和水.取12.6g的三聚氰胺晶体如图装置进行实验(假设三聚氰胺完全反应转化产物).
(1)抑制A装置中固体为Na2O2,请写出其中发生反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑;
(2)D装置不能与E装置互换的理由是浓硫酸吸水,碱石灰吸收二氧化碳,若互换位置,则碱石灰会同时吸收水和二氧化碳,导致实验失败;
(3)当B装置中反应完全发生后,读取G中的体积的使用操作顺序为②③①(填序号).
①读数②冷却至室温③调平F、G装置中的液面
(4)测定数据如下:
| 装置 | D | E |
| 实验前 | 101.0g | 56.0g |
| 实验后 | 106.4g | 69.2g |
①利用上述实验数据,计算三聚氰胺的量筒式为CN2H2;
②三聚氰胺的分子式为C3N6H6;
③若没有C装置中的铜网,对测定结果的影响是测定所得分子式的氮原子数偏大,而碳、氢原子数偏小.
14.下列各组物质不属于同系物的是( )
| A. | CH3-CH3 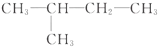 | B. | CH2═CH-CH3,CH2═CH-CH2-CH3 | ||
| C. | CH3-CH2-OH,CH3-CH2-CH2-CH3 | D. | 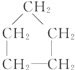 , ,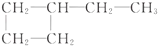 |
12.下列化学反应中,光照对它几乎没有影响的是( )
| A. | 氯气与氢气的反应 | B. | 氯气与甲烷的反应 | ||
| C. | 次氯酸的分解反应 | D. | 甲烷的分解反应 |
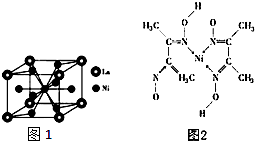 镍(Ni)是一种重要的金属,金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍(Ni)是一种重要的金属,金属镍及其化合物在合金材料以及催化剂等方面应用广泛. 、④HCHO其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形;
、④HCHO其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形;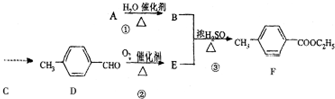
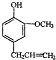 )是一种重要的调味剂,它与F的关系是b.
)是一种重要的调味剂,它与F的关系是b.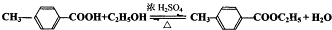 .
.