题目内容
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
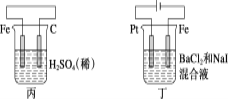
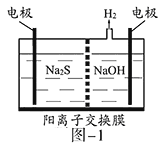
(1)将烧碱吸收H2S后的溶液加入到如题图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e-=S(n—1)S+ S2-=Sn2-。
①写出电解时阴极的电极反应式:__________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成_____________。
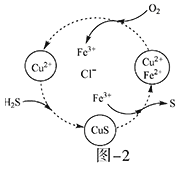
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如题图—2所示。
①在图示的转化中,化合价不变的元素是___________。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为_______________。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有___________________。
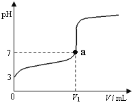
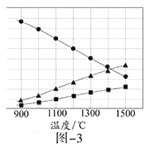
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题图—3所示,H2S在高温下分解反应的化学方程式为_____________。
【答案】2H2O+2e-=H2↑+2OH- Sn2-+2H+=(n-1)S↓+H2S↑ Cu、H、Cl 0.5 mol 提高空气的比例(增加氧气的通入量) 2H2S![]() 2H2+S2
2H2+S2
【解析】
(1)①阳极上硫离子放电,电极反应式为S2--2e-=S,阴极上氢离子放电生成氢气,电极反应式为2H2O+2e-=H2↑+2OH-,故答案为2H2O+2e-=H2↑+2OH-;
②电解后阳极区离子为Sn2-,酸性条件下,Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应生成S单质,同时S元素得电子生成H2S,反应方程式为Sn2-+2H+=(n-1)S↓+H2S↑,故答案为Sn2-+2H+=(n-1)S↓+H2S↑;
(2)①根据图中各元素化合价知,Cu元素化合价都是+2价、H元素化合价都是+1价、Cl元素化合价都是-1价,所以化合价不变的是Cu、H、Cl元素,故答案为Cu、H、Cl;
②H2S不稳定,易被氧气氧化生成S单质,反应方程式为2H2S+O2=2S+2H2O,该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,根据氧化还原反应中得失电子相等得,消耗O2的物质的量=![]() =0.5mol,故答案为0.5mol;
=0.5mol,故答案为0.5mol;
③欲使生成的硫单质中不含CuS,则硫离子不能剩余,即硫离子完全被氧化为S单质,所以氧气必须过量,采取的措施为提高混合气体中空气的比例,故答案为提高混合气体中空气的比例;
(3)根据题意知,该反应是可逆反应,反应物是硫化氢,根据图象知,生成物中含有S元素的物质是氢气的一半,则生成物是S2和H2,所以该反应方程式为2H2S![]() 2H2+S2,故答案为2H2S
2H2+S2,故答案为2H2S![]() 2H2+S2。
2H2+S2。

 快捷英语周周练系列答案
快捷英语周周练系列答案