题目内容
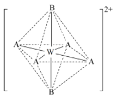
【题目】有关甲、乙、丙、丁四个图示的叙述正确的是( )

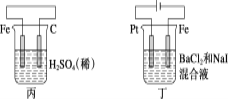
A.甲中负极反应式为2H++2e-=H2↑
B.乙中阳极反应式为Ag++e-=Ag
C.丙中H+向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
【答案】C
【解析】
由图可知:甲图为原电池,其中Zn为负极,失去电子,生成Zn2+;乙图为电解池,银与电源的正极相连接,为阳极,发生氧化反应;丙图为原电池,铁作负极,失去电子发生氧化反应,电解液中的H+得到电子,发生还原反应;丁图为电解池,铁与电源的负极相连,为阴极,Pt与电源的正极相连,为阳极,阳极上I-先失去电子发生氧化反应。
A. 甲图中Zn为负极,失去电子,生成Zn2+,电极反应式为:Zn-2e-= Zn2+,A项错误;
B. 乙图中银与电源的正极相连接,为阳极,发生氧化反应。乙中阳极反应式为Ag-e-=Ag+,B项错误;
C. 丙中铁作负极,失去电子发生氧化反应,电解液中的H+得到电子向正极移动,即H+向碳棒方向移动,C项正确;
D. 丁图中Pt与电源的正极相连,为阳极,阳极上I-先失去电子发生氧化反应,D项错误;
答案选C。

【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH=+181 kJ/mol
(1)若某反应的平衡常数表达式为K=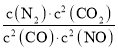 ,请写出此反应的热化学方程式:_______;下列措施能够增大此反应中NO的转化率的是(填字母代号)____________。
,请写出此反应的热化学方程式:_______;下列措施能够增大此反应中NO的转化率的是(填字母代号)____________。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
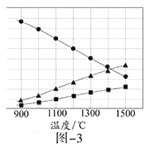
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min内,以CO2表示的该反应速率v(CO2)=______,该条件下的平衡常数K=_____。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______移动(填“正向”
(3)工业上可以用氨水除去反应C(s)+2NO(g)![]() N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O
N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=____________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11,水的离子积常数Kw=1×10-14)
NH3·H2O+H2CO3的平衡常数K=____________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11,水的离子积常数Kw=1×10-14)