题目内容
【题目】铬鞣剂[Cr(OH)SO4]可用于提高皮革的耐曲折强度。一种以铬渣(含Cr2O3及少量Fe2O3、CaO、Al2O3、SiO2等杂质)为原料制备Cr(OH)SO4的工艺流程如图:

回答下列问题:
(1)“焙烧”时,Cr2O3转化为Na2CrO4的化学方程式为__。
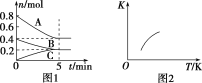
(2)“水浸”过程中,物料的粒度(颗粒大小)对铬残余量的影响如图所示,则最佳反应条件为__。

(3)“滤渣1”中有一种成分为铁铝酸四钙(Ca4Fe2Al2O10),是制造水泥的原料之一,用氧化物的形式表示其化学式__。
(4)“滤渣2”主要成分为Al(OH)3和__(填化学式),“过滤2”后,将溶液pH调至a,a__6.5(填“小于”或“大于”),目的是__(用离子方程式表示)。
(5)已知CH3OH在酸性条件下可被氧化生成CO2,写出Na2Cr2O7与CH3OH反应生成Cr(OH)SO4的化学方程式__。
(6)某厂用m1kg的铬渣(含Cr2O340%)制备Cr(OH)SO4,最终得到产品m2kg,则产率为__。
【答案】2Cr2O3+ 4Na2CO3+3O2![]() 4Na2CrO4 +4CO2 物质的粒度为60目时 4CaO·Fe2O3·Al2O3 H2SiO3 小于 2CrO42-+2H+
4Na2CrO4 +4CO2 物质的粒度为60目时 4CaO·Fe2O3·Al2O3 H2SiO3 小于 2CrO42-+2H+![]() Cr2O72-+H2O Na2Cr2O7+CH3OH+3H2SO4=2Cr(OH)SO4+CO2+ Na2SO4+4H2O
Cr2O72-+H2O Na2Cr2O7+CH3OH+3H2SO4=2Cr(OH)SO4+CO2+ Na2SO4+4H2O ![]()
【解析】
以铬渣(含Cr2O3及少量Fe2O3、CaO、Al2O3、SiO2等杂质)为原料制备Cr(OH)SO4,先加入碳酸钠、通入空气进行焙烧,再经过水浸、过滤除去固体杂质Fe2O3,调pH除去杂质氢氧化铝和氢氧化铁,最后通过氧化还原反应生成目标产物Cr(OH)SO4。
(1)“焙烧”时,Cr2O3转化为Na2CrO4,Cr元素的化合价升高,反应为氧化还原反应,还需氧化剂O2,根据电子守恒配平方程式为2Cr2O3+ 4Na2CO3+3O2![]() 4Na2CrO4 +4CO2。
4Na2CrO4 +4CO2。
(2)根据图示可知,当物质的粒度为60目时,铬的残余量最少,故最佳反应条件为物质的粒度为60目时。
(3)铁铝酸四钙(Ca4Fe2Al2O10),用氧化物的形式表示其化学式为4CaO·Fe2O3·Al2O3。
(4)步骤过滤1后溶液中存在偏铝酸钠和硅酸钠等杂质,调节pH使其转化为沉淀Al(OH)3和H2SiO3,故滤渣2主要成分为Al(OH)3和H2SiO3 。“过滤2”后,将溶液pH调至a,是为将2CrO42-转化为Cr2O72-,酸性条件下可以实现转化,故a小于6.5实现2CrO42-+2H+![]() Cr2O72-+H2O的转化。
Cr2O72-+H2O的转化。
(5)根据条件CH3OH在酸性条件下可被氧化生成CO2, Na2Cr2O7与CH3OH反应生成Cr(OH)SO4为氧化还原反应,其中碳元素、铬元素的化合价发生改变,根据电子守恒得化学反应方程式为Na2Cr2O7+CH3OH+3H2SO4=2Cr(OH)SO4+CO2+ Na2SO4+4H2O。
(6)最终得到产品Cr(OH)SO4m2kg,其中铬元素的含量为![]() kg,原料中铬元素的含量为
kg,原料中铬元素的含量为![]() ,则产率为
,则产率为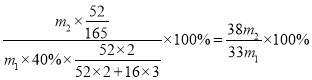 。
。

【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达到平衡时,X的转化率为50%
D.增大X的浓度,Y的转化率增大