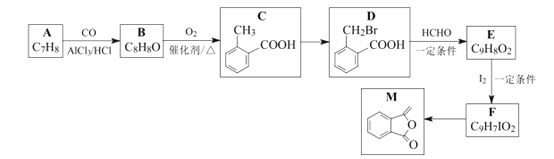
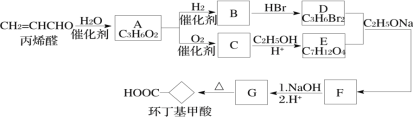
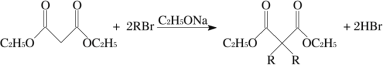
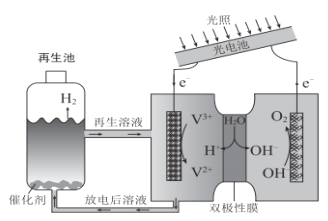
题目内容
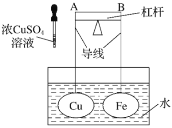
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
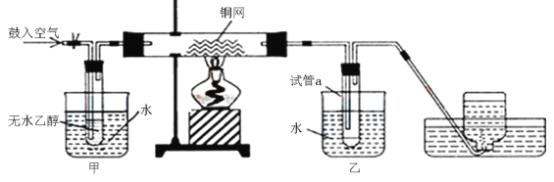
(1)实验过程中铜网处出现_______________现象,请写出相应的化学反应方程式:①___________,②___________;从中可认识到该实验过程中催化剂___________(填“参加”或“不参加”)化学反应。
(2)实验进行一段时间后,熄灭酒精灯,反应能继续进行,其原因是___________。
(3)甲和乙两个水浴作用不相同。甲的作用是___________;乙的作用___________ 。
(4)反应进行一段时间后,试管a中能收集到不同的物质,它们是___________。集气瓶中收集到的气体的主要成分是___________。(写名称)
【答案】先变黑再变红(红色黑色交替) 2Cu+O2![]() 2CuO C2H5OH+CuO
2CuO C2H5OH+CuO![]() CH3CHO+Cu+H2O 参加 该反应为放热反应 加热,使乙醇挥发 冷却,便于乙醛收集 乙醇、乙醛、水 氮气
CH3CHO+Cu+H2O 参加 该反应为放热反应 加热,使乙醇挥发 冷却,便于乙醛收集 乙醇、乙醛、水 氮气
【解析】
该实验将乙醇和空气都鼓入玻璃管中,玻璃管中的铜网在加热的条件下遇见氧气生成氧化铜,氧化铜再被乙醇还原生成铜。生成的乙醛和水及没反应的乙醇进入试管a中冷却下来,最后剩下的气体主要是氮气。
(1)在乙醇的催化氧化实验中,Cu作催化剂,反应过程中红色的Cu先被氧化为黑色的CuO,黑色的CuO又被乙醇还原为红色的Cu,所以现象是红色黑色交替,催化剂Cu参加了反应;有关的化学方程式为2Cu+O2![]() 2CuO;C2H5OH+CuO
2CuO;C2H5OH+CuO![]() CH3CHO+Cu+H2O;
CH3CHO+Cu+H2O;
(2)停止加热后反应依然能够进行,说明该反应放热,放出的热量能够让反应继续进行;
(3)根据分析,开始时需要将乙醇蒸汽吹入玻璃管,故需要加热,有利于乙醇的挥发;a管主要是将混合物液化,所以冷水浴,有利于乙醛的收集;
(4)根据分析,a管中主要收集到的物质是乙醇、乙醛、水;根据分析,空气中的氧气参加了反应,集气瓶中收集到的主要是氮气;

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案