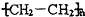题目内容
8.可能存在的第119号未知元素,有人称为“类钫”,它位于碱金属族,根据周期表结构及元素性质变化趋势,下列关于碱金属某些元素原子的结构和性质的判断,错误的是( )①锂与水反应比钠剧烈 ②碱金属单质都需要密封保存在煤油中 ③锂的氧化物暴露在空气中易吸收二氧化碳 ④锂的阳离子的最外层电子数和钠的相同 ⑤“类钫”单质是强还原剂 ⑥“类钫”在化合物中是+1价⑦“类钫”单质的密度大于l g•cm-3⑧“类钫”单质有较高的熔点.
| A. | ①②④⑧ | B. | ①②③⑦ | C. | ③④⑤⑧ | D. | ①③④⑦ |
分析 ①元素的金属性越强,对应的单质与水反应越剧烈;
②锂密度小于煤油密度;
③锂的氧化物氧化物是碱性氧化物,依据碱性氧化物性质判断;
④锂原子失去最外层电子后次外层变成最外层,锂离子最外层有2个电子,钠离子最外层有8个电子;
⑤“类钫”物质属于碱金属,依据碱金属的性质解答;
⑥依据碱金属原子结构特点解答;
⑦依据碱金属密度从上到下逐渐增大的规律解答;
⑧碱金属单质都属于金属晶体,熔点取决于离子键强弱.
解答 解:①金属性:Na>Li,元素的金属性越强,对应的单质与水反应越剧烈,则钠与水反应比锂与水反应剧烈,故错误;
②锂密度小于煤油密度,用煤油保存锂,起不到隔绝空气的作用,故错误;
③它的氧化物是碱性氧化物,所以它的氧化物在空气中易吸收二氧化碳,生成碳酸盐,故正确;
④锂原子失去最外层电子后次外层变成最外层,锂离子最外层有2个电子,钠离子最外层有8个电子,二者数目不相同,故错误;
⑤“类钫”物质属于碱金属,碱金属单质都具有强的还原性,故正确;
⑥碱金属原子结构特点,最外层都只有1个电子,在反应中容易失去电子显+1价,故正确;
⑦碱金属密度从上到下逐渐增大,“类钫”单质密度大于钫,密度大于l g•cm-3,故正确;
⑧碱金属单质都属于金属晶体,单质中离子键较弱,熔点较低,故错误;
故选:A.
点评 本题考查了碱金属的性质,熟悉同主族元素性质的递变规律是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.设阿伏加德罗常数为NA,则下列说法正确的是( )
| A. | 常温常压下,11.2 L甲烷中含有的氢原子数为2NA | |
| B. | 标准状况下,0.3 mol二氧化硫中含有的氧原子数为0.3NA | |
| C. | 常温常压下,2 g H2的分子数为NA | |
| D. | 常温常压下,1 mol/L MgCl2溶液中含Cl-数为2NA |
19.生活中的一些问题常涉及到化学知识,则下列叙述正确的是( )
| A. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 | |
| B. | 明矾和漂白粉常用于自来水的处理,两者的作用原理相同 | |
| C. | 氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,与铜发生置换反应 | |
| D. | 晶体硅具有半导体的性质,所以可以制作光导纤维 |
16.下列各组物质的性质比较中,正确的是( )
| A. | 热稳定性:Na2CO3>NaHCO3>H2CO3 | B. | 溶解度:Na2CO3<NaHCO3 | ||
| C. | 熔点:Rb>K>Na>Li | D. | 还原性:Rb<K<Na<Li |
3.下列措施不利于治理雾霾、改善空气质量的是( )
| A. | 推广使用燃煤脱硫技术 | B. | 实施绿化工程 | ||
| C. | 研制开发燃料电池汽车 | D. | 大力发展火电 |
13.关于氯水的叙述中不正确的是( )
| A. | 新制氯水的颜色比久置氯水深 | |
| B. | 新制氯水的酸性比久置氯水酸性弱 | |
| C. | 新制氯水和液氯的性质完全相同 | |
| D. | 氯水能使有色物质褪色体现了HClO的漂白性 |
20.取m g相对原子质量为M的某金属与足量稀硫酸反应,在标准状况下产生a L氢气,该反应生成的硫酸盐中金属的化合价为( )
| A. | +$\frac{aM}{11.2m}$ | B. | +$\frac{am}{11.2M}$ | C. | +$\frac{11,2m}{aM}$ | D. | +$\frac{aM}{22.4m}$ |
17.检验某未知溶液中是否含有SO42-,下列操作最合理的是( )
| A. | 加入HNO3酸化的Ba(NO3)2溶液 | |
| B. | 先加入HNO3酸化,再加Ba(NO3)2 | |
| C. | 加入盐酸酸化的BaCl2 | |
| D. | 先用盐酸酸化,若有沉淀,则过滤,滤液中再加BaCl2溶液 |
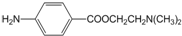 )的三条合成路线如图所示(部分反应试剂和条件已省略):
)的三条合成路线如图所示(部分反应试剂和条件已省略):
 ;C中官能团的名称是氨基和羧基.
;C中官能团的名称是氨基和羧基. ;1mol该物质与NaOH溶液共热最多消耗2mol NaOH.
;1mol该物质与NaOH溶液共热最多消耗2mol NaOH.