题目内容
6.有几种元素的粒子核外电子排布式均为1s22s22p63s23p6,其中:(1)某电中性微粒一般不和其他元素的原子反应,这种微粒的符号是Ar;
(2)某微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒的符号是S2-;
(3)某微粒氧化性很弱,但得到电子后还原性很强,且这种原子有一个单电子,这种微粒的符号是K+
(4)某微粒还原性虽弱,但失去电子后氧化性强,且这种元素的原子得到一个电子即达稳定结构,这种微粒的符号是Cl-.
分析 (1)根据电中性微粒化学性质稳定说明是具有稳定结构原子;
(2)该微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒是硫离子,阴离子:质子数=核外电子数-所带电荷数;
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种微粒为钾离子;
(4)该微粒的还原性很弱,失去一个电子后变为原子,原子的氧化性很强,这种微粒为氯离子.
解答 解:(1)根据题意可知:电中性微粒化学性质稳定,是具有稳定结构原子,质子数等于核外电子数为18,该粒子为Ar,故答案为:Ar;
(2)该微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒是硫离子,故答案为:S2-;
(3)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种微粒为钾离子,故答案为:K+;
(4)该微粒的还原性很弱,失去一个电子后变为原子,原子的氧化性很强,这种微粒为氯离子,故答案为:Cl-.
点评 本题考查核外电子排布式均为1s22s22p63s23p6即核外共有18个电子,要注意阴离子:质子数=核外电子数-电荷数,阳离子=核外电子数+电荷数.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.每种物质都既有离子键,又有共价键的一组物质是( )
| A. | NaOH、H2SO4、(NH4)2SO4 | B. | MgO、Na2SO4、NH4HCO3 | ||
| C. | Na2O2、NH4Cl、Na2SO4 | D. | HCl、Al2O3、MgCl2 |
17.某有机物除含碳氢元素外,可能含有氧元素.取该物质a g在足量O2 中充分燃烧后,在120℃下将产物全部通过足量的过氧化钠,充分反应后,过氧化钠固体质量也增加ag.则下列说法正确的是( )
| A. | 该物质中不一定含有氧元素 | |
| B. | 该物质的分子组成必须满足n(C)=n(H) | |
| C. | 该物质中一定含有氧元素,且必须满足n(C)=n(O) | |
| D. | 该物质一定不溶于水 |
14.下列说法正确的是( )
| A. | 按系统命名法,有机物 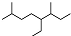 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 结构片段为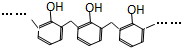 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
1.科学家最近发现两种粒子;第一种是只由四个中子构成的粒子,这种粒子称为“四中子”也有人称之为“零号元素”.第二种是由四个氧原子构成的分子,下列有关这两种粒子的说法不正确的是( )
| A. | 第二种粒子是氧元素的另一种核素 | |
| B. | “四中子”的质量数为4,其质量比氢原子大 | |
| C. | “四中子”不显电性 | |
| D. | 第二种粒子的化学式为O4,与O2互为同素异形体 |
11.某反应的反应过程中能量变化如图所示.下列有关叙述正确的是( )
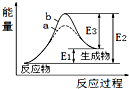

| A. | 该反应为放热反应 | |
| B. | b表示的有催化剂 | |
| C. | 催化剂能降低正、逆反应的活化能 | |
| D. | 逆反应的活化能大于正反应的活化能 |
18.药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得(已知在中学阶段羧基、酯基、酰胺基(-CONH-)不与氢气发生加成反应,给特殊信息除外,下同):
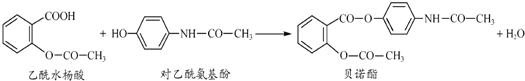
下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 1mol贝诺酯分子可与6molH2完全反应 | |
| B. | 可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 | |
| D. | 乙酰水杨酸和对乙酰氨基酚均可与NaHCO3 溶液反应 |
16.常温下0.2mol/L的一元素HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度大小为:0.1mol/L>c(X)>c(Y)>c(Z),下列说法正确的是( )
| A. | HA为强酸 | B. | 该混合液pH=7 | ||
| C. | X表示HA,Y表示OH,Z表示H+ | D. | 该混合溶液中:c(A-)+c(Y)=c(Na+) |
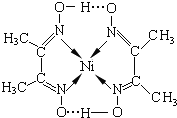 分子内含有的作用力有ACE(填序号).
分子内含有的作用力有ACE(填序号).