题目内容
14.下列说法正确的是( )| A. | 按系统命名法,有机物 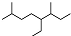 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 结构片段为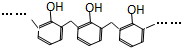 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
分析 A.该命名不满足取代基的编号之和最小原则;
B.烃CxHy完全燃烧耗氧量由(x+$\frac{y}{4}$)值决定;烃的含氧衍生物CxHyOz完全燃烧耗氧量由(x+$\frac{y}{4}$-$\frac{z}{2}$)值决定,据此判断;
C.苯和甲苯互为同系物,但苯不能使KMnO4酸性溶液褪色;
D.根据苯酚和甲醛发生缩聚反应.
解答 解:A.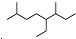 的命名中,取代基的编号之和不是最小的,说明编号方向错误,正确命名为2,6-二甲基-5-乙基辛烷,故A错误;
的命名中,取代基的编号之和不是最小的,说明编号方向错误,正确命名为2,6-二甲基-5-乙基辛烷,故A错误;
B.苯的x+$\frac{y}{4}$=6+$\frac{6}{4}$=7.5,即1mol苯消耗氧气7.5mol,苯甲酸的x+$\frac{y}{4}-\frac{z}{2}$=7+$\frac{6}{4}$-1=7.5,即1mol苯甲酸消耗氧气7.5mol,所以等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等,故B错误;
C.苯和甲苯互为同系物,但苯不能使KMnO4酸性溶液褪色,故C错误;
D.苯酚和甲醛发生缩聚反应得到酚醛树酯,结构片段
故选:D.
点评 本题主要考查了物质的命名、燃烧规律、物质的性质以及缩聚反应,需要注意的是酚醛发生缩聚反应的规律.

练习册系列答案
相关题目
4. 如图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,实验过程中,所涉及的三次分离操作分别是( )
如图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,实验过程中,所涉及的三次分离操作分别是( )
 如图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,实验过程中,所涉及的三次分离操作分别是( )
如图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,实验过程中,所涉及的三次分离操作分别是( )| A. | ①蒸馏 ②过滤 ③分液 | B. | ①分液 ②蒸馏 ③过滤 | ||
| C. | ①蒸馏 ②分液 ③分液 | D. | ①分液 ②蒸馏 ③蒸馏 |
9.汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:Pb (s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l),根据此反应判断下列叙述中正确的是( )
| A. | PbO2是电池的负极 | |
| B. | 负极的电极反应式为:Pb(s)+SO42-(aq)-2e -=PbSO4(s) | |
| C. | 铅蓄电池属于一次电池 | |
| D. | 电池放电时,溶液酸性增强 |
19.镭是元素周期表中第七周期第ⅡA族元素,关于其叙述不正确的是( )
| A. | 镭的金属性比钙弱 | B. | 单质能与水反应生成氢气 | ||
| C. | 在化合物中呈+2价 | D. | 碳酸镭难溶于水 |
3. 乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)
乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)
填空:
(1)写出H2C2O4的电离方程式H2C2O4?H++HC2O4-;HC2O4-?H++C2O42-,.
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度;向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是ad.
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(Na+)=c(H2C2O4)+c(C2O42-)
c.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
d.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O;又知该反应开始时速率较慢,随后大大加快,可能的原因是反应生成的Mn2+对该反应具有催化作用.
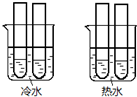
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL 0.1 mol/L H2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
(5)已知草酸(H2C2O4)受热分解的化学方程式为:H2C2O4→H2O+CO↑+CO2↑,写出FeC2O4在密闭容器中高温分解的化学方程式FeC2O4$\frac{\underline{\;高温\;}}{\;}$Fe+2CO2↑.
 乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)
乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
(1)写出H2C2O4的电离方程式H2C2O4?H++HC2O4-;HC2O4-?H++C2O42-,.
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度;向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是ad.
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(Na+)=c(H2C2O4)+c(C2O42-)
c.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
d.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O;又知该反应开始时速率较慢,随后大大加快,可能的原因是反应生成的Mn2+对该反应具有催化作用.
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL 0.1 mol/L H2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
(5)已知草酸(H2C2O4)受热分解的化学方程式为:H2C2O4→H2O+CO↑+CO2↑,写出FeC2O4在密闭容器中高温分解的化学方程式FeC2O4$\frac{\underline{\;高温\;}}{\;}$Fe+2CO2↑.
4.X、Y、Z、W为四种短周期元素,它们在周期表中位于连续的四个主族,如图所示.Z元素原子最外层电子数是内层电子总数的$\frac{1}{5}$.下列说法中正确的是( )
| X | Y | ||
| Z | W |
| A. | 原子半径由小到大的顺序为X<Z<Y<W | |
| B. | Y元素最高价氧化物对应的水化物化学式为HYO3 | |
| C. | X、Z两种元素的氧化物中所含化学键类型相同 | |
| D. | Y最简单气态氢化物比Y相邻周期同主族元素气态氢化物沸点高 |
 例如:
例如: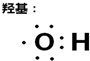
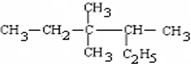 的名称3,3,4-三甲基己烷
的名称3,3,4-三甲基己烷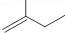 的名称2-甲基-1-丁烯.
的名称2-甲基-1-丁烯.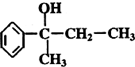 在工业上用基础的石油产品(乙烯、丙烯等)进行合成.合成A的过程可表示为:
在工业上用基础的石油产品(乙烯、丙烯等)进行合成.合成A的过程可表示为: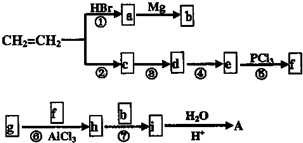

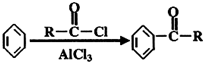
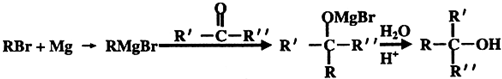
 ;
;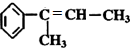 .
.