题目内容
【题目】某学习小组为了探究Fe(NO3)3的热稳定性和氧化性,设计如下实验:
实验(一): 热稳定性
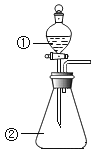
利用如图装置进行实验,加热A中Fe(NO3)3固体,A 和B中都有红棕色气体产生,A 试管中生成了红色粉末。
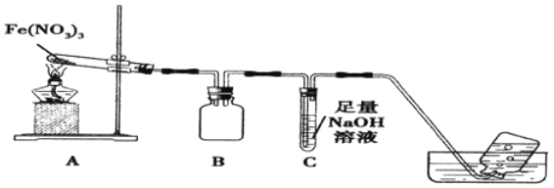
(1)B装置的作用____________;要检验A中红色固体是否为Fe2O3,应该选用的试剂是____________(填化学式)。
(2)加热A中试管一段时间后,C 中导管口有气泡产生,而集气瓶中无气泡产生原因是______________。
(3)写出硝酸铁受热分解的化学方程式__________________。
实验(二):氧化性
Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点。该小组设计如下实验:
试验编号 | 实验操作 | 现象 |
a | 向10mL3mol·L-1KNO3酸性溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 无沉淀生成 |
b | 向10mL3mol·L-1AgNO3溶液中滴加2mL0.1mol·L-1FeSO4溶液,振荡;再滴加酸性高锰酸钾溶液 | 紫红色溶液不褪色 |
c | 向10 mL3mol·L-1Fe(NO3)3溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 产生白色沉淀 |
(4)设计实验a的目的是_____________________;实验c的结论是_____________________________。
(5)实验b涉及反应的离子方程式为____________________________________。
(6)实验结论是Fe3+、Ag+氧化性的相对强弱与离子的_____________________有关。
【答案】 防倒吸 HCl、KSCN NO2、O2恰好与氢氧化钠溶液完全反应 4Fe(NO3)3![]() 2Fe2O3+12NO2↑+3O2↑ 排除NO3-的干扰 Fe3+能氧化Ag Ag++Fe2+=Fe3++Ag 浓度
2Fe2O3+12NO2↑+3O2↑ 排除NO3-的干扰 Fe3+能氧化Ag Ag++Fe2+=Fe3++Ag 浓度
【解析】(1)B装置中两个导管刚刚露出胶塞,所以B装置起到防止倒吸的作用;要检验A中红色固体是否为Fe2O3,需要将残留固体溶于水,过滤,取滤渣溶解于HCl或者稀H2SO4,因为Fe2O3与H+反应生成Fe3+,再用KSCN试剂检验Fe3+的存在,若溶液变成血红色,红色固体是Fe2O3,所以需要的试剂是盐酸或者稀硫酸与KSCN溶液;
(2)加热A中Fe(NO3)3固体,A 和B中都有红棕色气体产生,A 试管中生成了红色粉末,发生反应的方程式:4Fe(NO3)3![]() 2Fe2O3+12NO2↑+3O2 ↑,4NO2+O2 +4NaOH=4NaNO3+2H2O,NO2与O2的混合气体恰好被NaOH溶液吸收,所以C 中导管口有气泡产生,产生的气泡被NaOH吸收,集气瓶中自然就无气泡产生了,所以正确答案是:NO2、O2恰好与氢氧化钠溶液完全反应;
2Fe2O3+12NO2↑+3O2 ↑,4NO2+O2 +4NaOH=4NaNO3+2H2O,NO2与O2的混合气体恰好被NaOH溶液吸收,所以C 中导管口有气泡产生,产生的气泡被NaOH吸收,集气瓶中自然就无气泡产生了,所以正确答案是:NO2、O2恰好与氢氧化钠溶液完全反应;
(3)根据(2)的解析可知:硝酸铁受热分解的化学方程式4Fe(NO3)3![]() 2Fe2O3+12NO2↑+3O2 ↑;
2Fe2O3+12NO2↑+3O2 ↑;
(4)利用a实验验证NO3-离子在酸性条件下能否将Ag氧化为Ag+,根据实验现象,说明在pH=1的情况下,NO3-离子不能够将Ag氧化,排除了NO3-离子对后续实验的干扰作用,正确答案:排除NO3-的干扰;根据c实验的现象可知:Fe3++Ag=Fe2++Ag+,Ag++Cl-=AgCl↓,说明Fe3+能氧化Ag;
(5)向10mL3mol·L-1AgNO3溶液中滴加2mL0.1mol·L-1FeSO4溶液,振荡;再滴加酸性高锰酸钾溶液 紫红色溶液不褪色,说明溶液中已经没有Fe2+,Fe2+已经被溶液中的Ag+离子氧化了,即:Fe2+ +Ag+=Fe3+ Ag,所以b涉及反应的离子方程式是:Fe2+ +Ag+=Fe3+ +Ag;
(6)对照实验b中Ag+浓度大,可以将Fe2+氧化,c中Fe3+离子浓度大,可以将Ag氧化,因此,Fe3+、Ag+氧化性的相对强弱与溶液中两种离子的浓度有关。

【题目】Ⅰ.有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和黏合剂等高聚物。为研究X的组成与结构,进行了如下实验:
(1)有机物X的质谱图为: | |
| 有机物X的相对分子质量是________。 |
(2)将10.0 g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。 | 有机物X的分子式是______。 |
(3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3∶1。 | 有机物X的结构简式是__________。 |
II.写出与![]() 互为同分异构体,且一溴代物只有两种的芳香烃的结构简式和名称:________________、___________。
互为同分异构体,且一溴代物只有两种的芳香烃的结构简式和名称:________________、___________。